Yazar:
Frank Hunt
Yaratılış Tarihi:
16 Mart 2021
Güncelleme Tarihi:
1 Temmuz 2024
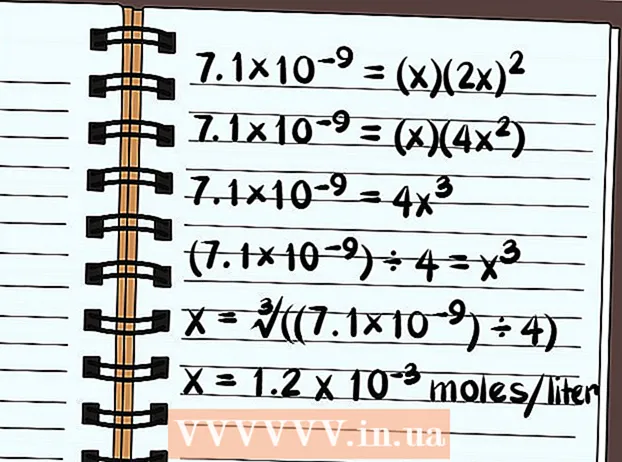
İçerik
- Adım atmak
- Yöntem 1/2: Hızlı kuralları kullanma
- Yöntem 2/2: K'nin çözünürlüğünün hesaplanmasısp
- Gereklilikler
- İpuçları
- Uyarılar
Kimyada çözünürlük, çözünmemiş parçacıklar bırakmadan bir sıvı ile karıştırılan ve içinde tamamen çözünen bir katının özelliklerini tanımlamak için kullanılır. Yalnızca (yüklü) iyonik bileşikler çözünür. Pratik amaçlar için, birkaç kuralı ezberlemek veya bir kurallar listesine başvurmak, çoğu iyonik bileşiğin suyla karıştırıldığında katı kalıp kalmayacağını veya önemli bir miktarının çözülüp çözülmeyeceğini söylemek için yeterlidir. Gerçekte, bazı moleküller herhangi bir değişiklik görmeseniz bile çözülür, bu nedenle kesin deneyler için bu miktarı nasıl hesaplayacağınızı bilmeniz gerekir.
Adım atmak
Yöntem 1/2: Hızlı kuralları kullanma
 İyonik bileşikler hakkında daha fazla bilgi edinin. Normalde her atom bir dizi elektrona sahiptir, ancak bazen fazladan bir elektron kazanır veya kaybederler. Sonuç bir iyon elektrik yükü ile. Negatif yüklü (ekstra elektron) bir iyon, pozitif yüklü bir iyonla karşılaştığında (bir elektron eksik), iki mıknatısın negatif ve pozitif uçları gibi birbirlerine bağlanırlar. Sonuç, iyonik bir bağdır.
İyonik bileşikler hakkında daha fazla bilgi edinin. Normalde her atom bir dizi elektrona sahiptir, ancak bazen fazladan bir elektron kazanır veya kaybederler. Sonuç bir iyon elektrik yükü ile. Negatif yüklü (ekstra elektron) bir iyon, pozitif yüklü bir iyonla karşılaştığında (bir elektron eksik), iki mıknatısın negatif ve pozitif uçları gibi birbirlerine bağlanırlar. Sonuç, iyonik bir bağdır. - Negatif yüklü iyonlara anyonlarve pozitif yüklü iyonlar katyonlar.
- Normalde, bir atomdaki elektron sayısı, elektrik yüklerinin dengede olduğu protonların sayısına eşittir.
 Çözünürlüğü bilin. Su molekülleri (H.2O) bir mıknatıs gibi davrandıkları alışılmadık bir yapıya sahip: bir ucu pozitif, diğer ucu negatif yüklü. İyonik bir bağı suyla karıştırdığınızda, bu "su mıknatısları" çevresinde toplanarak pozitif ve negatif iyonları ayırmaya çalışır. Bazı iyonik bağlar birbirine çok sıkı değildir; bunlar çözünürçünkü su bağı koparır ve çözer. Diğer kompozitler daha güçlü bağlara sahiptir ve Çözülemezçünkü su moleküllerine rağmen birbirine yapışabilirler.
Çözünürlüğü bilin. Su molekülleri (H.2O) bir mıknatıs gibi davrandıkları alışılmadık bir yapıya sahip: bir ucu pozitif, diğer ucu negatif yüklü. İyonik bir bağı suyla karıştırdığınızda, bu "su mıknatısları" çevresinde toplanarak pozitif ve negatif iyonları ayırmaya çalışır. Bazı iyonik bağlar birbirine çok sıkı değildir; bunlar çözünürçünkü su bağı koparır ve çözer. Diğer kompozitler daha güçlü bağlara sahiptir ve Çözülemezçünkü su moleküllerine rağmen birbirine yapışabilirler. - Bazı bağlantıların gücü su çekişine benzer iç bağlara sahiptir. Bu maddeler orta derecede çözünürçünkü tahvillerin önemli bir kısmı (ama hepsi değil) ayrılacak.
 Çözünürlük kurallarını inceleyin. Atomlar arasındaki etkileşimler oldukça karmaşık olduğundan, hangi bileşiklerin çözünür ve çözünmez olduğu her zaman sezgisel değildir. Genelde nasıl davrandığını öğrenmek için aşağıdaki listedeki bileşikteki ilk iyonu bulun, ardından ikinci iyonun anormal şekilde etkileşmediğinden emin olmak için istisnaları kontrol edin.
Çözünürlük kurallarını inceleyin. Atomlar arasındaki etkileşimler oldukça karmaşık olduğundan, hangi bileşiklerin çözünür ve çözünmez olduğu her zaman sezgisel değildir. Genelde nasıl davrandığını öğrenmek için aşağıdaki listedeki bileşikteki ilk iyonu bulun, ardından ikinci iyonun anormal şekilde etkileşmediğinden emin olmak için istisnaları kontrol edin. - Örneğin, stronsiyum klorür (SrCl2), aşağıda gösterilen kalın adımlarda Sr veya Cl arayın. Cl "çoğunlukla çözülebilir" olduğundan, aşağıdaki istisnaları kontrol edin. Sr bir istisna olarak gösterilmemiştir, bu nedenle SrCl2 çözülebilir.
- Her kuralın en yaygın istisnaları aşağıda listelenmiştir. Başka istisnalar da var, ancak muhtemelen bunları ortak bir kimya sınıfında veya laboratuarında bulamayacaksınız.
 Bileşikler Li, Na, K, Rb ve Cs dahil alkali metaller içerdiklerinde çözünürler. Bunlar aynı zamanda Grup IA'nın elementleri olarak da adlandırılır: lityum, sodyum, potasyum, rubidyum ve sezyum. Bu iyonlardan herhangi birine sahip hemen hemen her bileşik çözünür.
Bileşikler Li, Na, K, Rb ve Cs dahil alkali metaller içerdiklerinde çözünürler. Bunlar aynı zamanda Grup IA'nın elementleri olarak da adlandırılır: lityum, sodyum, potasyum, rubidyum ve sezyum. Bu iyonlardan herhangi birine sahip hemen hemen her bileşik çözünür. - İstisna: Li3PO4 çözünmez.
 NO içeren bileşikler3, C2H.3Ö2, HAYIR2, ClO3 ve ClO4 çözülebilir. Bunlar sırasıyla nitrat, asetat, nitrit, klorat ve perklorat iyonlarıdır. Asetatın genellikle OAc ile kısaltıldığına dikkat edin.
NO içeren bileşikler3, C2H.3Ö2, HAYIR2, ClO3 ve ClO4 çözülebilir. Bunlar sırasıyla nitrat, asetat, nitrit, klorat ve perklorat iyonlarıdır. Asetatın genellikle OAc ile kısaltıldığına dikkat edin. - İstisnalar: Ag (OAc) (gümüş asetat) ve Hg (OAc)2 (cıva asetat) çözünmez.
- AgNO2 ve KClO4 sadece "kısmen çözünür".
 Cl, Br ve I içeren bileşikler genellikle çözünürdür. Klorür, bromür ve iyodür iyonları hemen hemen her zaman çözünebilir bileşikler oluşturur, bunlar aynı zamanda halojen tuzları olarak da bilinir.
Cl, Br ve I içeren bileşikler genellikle çözünürdür. Klorür, bromür ve iyodür iyonları hemen hemen her zaman çözünebilir bileşikler oluşturur, bunlar aynı zamanda halojen tuzları olarak da bilinir. - İstisna: Bunlardan herhangi biri gümüş (Ag), cıva (Hg2) veya kurşun (Pb), sonuç çözülebilir değildir. Aynısı, bakır (Cu) ve talyum (Tl) içeren daha az yaygın bileşikler için de geçerlidir.
 SO'ya bağlantılar4 genellikle çözünürdür. Sülfat iyonu genellikle çözünür bileşikler oluşturur, ancak birkaç istisna vardır.
SO'ya bağlantılar4 genellikle çözünürdür. Sülfat iyonu genellikle çözünür bileşikler oluşturur, ancak birkaç istisna vardır. - İstisnalar: Sülfat iyonu, aşağıdaki iyonlarla çözünmeyen bileşikler oluşturur: stronsiyum Sr, baryum Ba, kurşun Pb, gümüş Ag, kalsiyum Ca, radyum Ra ve diatomik gümüş Ag2. Gümüş sülfat ve kalsiyum sülfatın bazen idareli çözünür olarak adlandırılacak kadar çözündüğüne dikkat edin.
 OH veya S içeren bileşikler çözünür değildir. Bunlar sırasıyla hidroksit ve sülfit iyonlarıdır.
OH veya S içeren bileşikler çözünür değildir. Bunlar sırasıyla hidroksit ve sülfit iyonlarıdır. - İstisnalar: Alkali metalleri (Grup I-A) ve çözünmeyen bileşikler oluşturmayı ne kadar sevdiklerini hatırlıyor musunuz? Li, Na, K, Rb ve Cs, hidroksit veya sülfit iyonları ile çözünür bileşikler oluşturur. Ek olarak, hidroksit, alkali toprak metalleri (Grup II-A) iyonları ile çözünür tuzlar oluşturur: kalsiyum Ca, stronsiyum Sr ve baryum Ba. Alkali toprak bileşiği içeren hidroksitin, bazen "idareli çözünür" olarak kabul edilmesi için birbirine yapışmaya yetecek kadar molekülü olduğuna dikkat edin.
 CO içeren bileşikler3 veya PO4 çözünmez. Karbonat ve fosfat iyonları için son bir kez kontrol edin ve bileşikten ne bekleyeceğinizi bilmelisiniz.
CO içeren bileşikler3 veya PO4 çözünmez. Karbonat ve fosfat iyonları için son bir kez kontrol edin ve bileşikten ne bekleyeceğinizi bilmelisiniz. - İstisnalar: Bu iyonlar, olağan maddeler, Li, Na, K, Rb ve Cs alkali metalleri ve amonyum NH ile çözünür bileşikler oluşturur.4.
Yöntem 2/2: K'nin çözünürlüğünün hesaplanmasısp
 K sabitinin çözünürlük ürününe bakın.sp. Bu sabit her bağlantı için farklıdır, bu nedenle ders kitabınızdaki bir tabloda veya çevrimiçi olarak bakmanız gerekecektir. Bu değerler deneysel olarak belirlendiğinden, tablodan tabloya büyük farklılıklar gösterebilirler, bu nedenle varsa, ders kitabınızdaki tabloyu kullanmak en iyisidir. Aksi belirtilmedikçe, çoğu tablo ortam sıcaklığının 25o C olduğunu varsaymaktadır.
K sabitinin çözünürlük ürününe bakın.sp. Bu sabit her bağlantı için farklıdır, bu nedenle ders kitabınızdaki bir tabloda veya çevrimiçi olarak bakmanız gerekecektir. Bu değerler deneysel olarak belirlendiğinden, tablodan tabloya büyük farklılıklar gösterebilirler, bu nedenle varsa, ders kitabınızdaki tabloyu kullanmak en iyisidir. Aksi belirtilmedikçe, çoğu tablo ortam sıcaklığının 25o C olduğunu varsaymaktadır. - Örneğin, kurşun iyodürü (PbI2), çözünürlük ürününün denge sabitini yazın. Bilbo.chm.uri.edu'da bir masa kullanıyorsanız, 7,1 × 10 sabitini kullanın.
 Önce kimyasal denklemi yazın. İlk önce, bileşiğin çözündüğünde iyonlara nasıl ayrıldığını belirleyin. Şimdi K ile bir denklem yazın.sp bir yanda ve diğer yanda tek tek iyonlar.
Önce kimyasal denklemi yazın. İlk önce, bileşiğin çözündüğünde iyonlara nasıl ayrıldığını belirleyin. Şimdi K ile bir denklem yazın.sp bir yanda ve diğer yanda tek tek iyonlar. - Örneğin, bir PbI molekülü2 Pb, I ve diğer I iyonlarına ayrılır (yalnızca bir iyonun yükünü bilmeniz veya aramanız gerekir, çünkü toplam bileşiğin her zaman nötr bir yüke sahip olduğunu bilirsiniz).
- 7.1 × 10 = [Pb] [I] denklemini yazın
 Değişkenleri kullanmak için denklemi ayarlayın. Denklemi molekül veya iyon sayısı bilginizi kullanarak tek bir cebir problemi olarak yeniden yazın. X'i çözünecek maddenin miktarına eşit olarak ayarlayın ve değişkenleri her iyonun x cinsinden sayıları olarak yeniden yazın.
Değişkenleri kullanmak için denklemi ayarlayın. Denklemi molekül veya iyon sayısı bilginizi kullanarak tek bir cebir problemi olarak yeniden yazın. X'i çözünecek maddenin miktarına eşit olarak ayarlayın ve değişkenleri her iyonun x cinsinden sayıları olarak yeniden yazın. - Örneğimizde, 7.1 × 10 = [Pb] [I]
- Bileşikte yalnızca bir kurşun iyonu (Pb) olduğundan, çözünmüş bileşik moleküllerinin sayısı, serbest kurşun iyonlarının sayısına eşit olacaktır. Böylece [Pb] 'yi x ile değiştirebiliriz.
- Her kurşun iyonu için iki iyot iyonu (I) olduğundan, iyot atomlarının sayısını 2x'e eşitleyebiliriz.
- Denklem şimdi 7,1 × 10 = (x) (2x) yazıyor
 Varsa ortak iyonları düşünün. Bileşiği saf suda çözüyorsanız bu adımı atlayın. Bununla birlikte, bileşik, bir veya daha fazla bileşen iyonu (bir "ortak iyon") içeren bir çözelti içinde çözülürse, çözünürlük önemli ölçüde azalır. Yaygın iyonların etkisi en çok çözülmeyen bileşiklerde belirgindir ve bu durumlarda dengede bulunan iyonların büyük çoğunluğunun çözeltide zaten mevcut olan iyondan geldiği varsayılabilir. Denklemi, halihazırda çözeltide bulunan iyonların bilinen molar konsantrasyonuyla (litre başına mol veya M), o iyon için kullandığınız x değerini değiştirerek yeniden yazın.
Varsa ortak iyonları düşünün. Bileşiği saf suda çözüyorsanız bu adımı atlayın. Bununla birlikte, bileşik, bir veya daha fazla bileşen iyonu (bir "ortak iyon") içeren bir çözelti içinde çözülürse, çözünürlük önemli ölçüde azalır. Yaygın iyonların etkisi en çok çözülmeyen bileşiklerde belirgindir ve bu durumlarda dengede bulunan iyonların büyük çoğunluğunun çözeltide zaten mevcut olan iyondan geldiği varsayılabilir. Denklemi, halihazırda çözeltide bulunan iyonların bilinen molar konsantrasyonuyla (litre başına mol veya M), o iyon için kullandığınız x değerini değiştirerek yeniden yazın. - Örneğin, kurşun-iyot bileşiğimiz 0,2 M kurşun klorür (PbCl2), sonra denklemi 7.1 × 10 = (0.2M + x) (2x) olarak yeniden yazabiliriz. Ve sonra, 0.2M, x'ten çok daha yüksek bir konsantrasyon olduğu için, bunu güvenle 7.1 × 10 = (0.2M) (2x) olarak yeniden yazabiliriz.
 Denklemi çözün. X'i çözün ve bileşiğin ne kadar çözünür olduğunu öğrenin. Çözünürlük sabitinin tanımlanma şekli nedeniyle, cevabınız litre su başına çözünmüş bileşiğin mol sayısı olarak ifade edilecektir. Son cevabı bulmak için bir hesap makinesine ihtiyacınız olabilir.
Denklemi çözün. X'i çözün ve bileşiğin ne kadar çözünür olduğunu öğrenin. Çözünürlük sabitinin tanımlanma şekli nedeniyle, cevabınız litre su başına çözünmüş bileşiğin mol sayısı olarak ifade edilecektir. Son cevabı bulmak için bir hesap makinesine ihtiyacınız olabilir. - Aşağıdakiler, herhangi bir ortak iyonla değil, saf sudaki çözünürlük için geçerlidir.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = Litre başına 1,2 x 10 mol çözülür. Bu çok küçük bir miktar, dolayısıyla bu bileşiğin prensipte zayıf bir şekilde çözünür olduğunu biliyorsunuz.
Gereklilikler
- Çözünürlük ürünleri için sabitler tablosu (K.sp) bağlantılar için.
İpuçları
- Bir bileşiğin çözünme derecesi hakkında deneylerden elde edilen verileriniz varsa, çözünürlük sabiti K'yi çözmek için aynı denklemi kullanabilirsiniz.sp.
Uyarılar
- Bu terimlerin evrensel olarak kabul edilmiş bir tanımı yoktur, ancak kimyagerler bileşiklerin çoğu üzerinde hemfikirdir. Önemli oranda çözünmüş ve çözünmemiş molekül içeren bileşiklerle ilgili bazı marjinal durumlar, farklı çözünürlük tabloları ile açıklanabilir.
- Bazı eski ders kitapları NH4Yine çözülebilir bir bileşim olarak OH. Bu yanlış; az miktarda NH4 ve OH iyonları gözlemlenebilir, ancak bir bileşik oluşturmak için izole edilemez.



