Yazar:
Randy Alexander
Yaratılış Tarihi:
25 Nisan 2021
Güncelleme Tarihi:
26 Haziran 2024
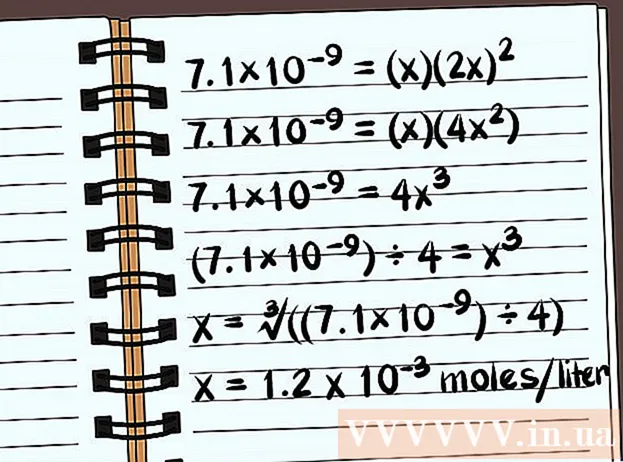
İçerik
Kimyada çözünürlük, herhangi bir çözünmez kalıntı bırakmadan bir sıvı içinde tamamen çözüldüğünde katı bir bileşiğin özelliklerini tanımlamak için kullanılır. Yalnızca iyonik bileşikler (yüklü) çözünür. Aslında, bir iyonik bileşiğin suya eklendiğinde katı kalıp kalmayacağını veya büyük miktarda çözündüğünü bilmek için yalnızca birkaç prensibi ezberlemeniz veya literatüre bakmanız gerekir. Aslında, herhangi bir değişiklik görmeseniz bile belirli bir miktarda molekül çözünecektir, bu nedenle deneyin doğru olması için bu miktardaki çözünen maddenin nasıl hesaplanacağını bilmeniz gerekir.
Adımlar
Yöntem 1/2: Hızlı kuralları kullanın
İyonik bileşikler hakkında bilgi edinin. Her atom genellikle belirli sayıda elektrona sahiptir, ancak bazen bir elektron alır veya verir. Bu süreç onu bir iyonlar ücretlidir. Negatif yüklü bir iyon (bir elektrondan fazla), pozitif yüklü (elektron eksik) bir iyonla karşılaştığında, iki mıknatısın katot ve anotu gibi birbirine bağlanırlar. Sonuç, iyonik bir bileşik oluşturur.
- İyonların negatif yükü var anyonlarve iyonların pozitif yükü vardır. katyon.
- Normalde bir atomdaki elektronların sayısı protonların sayısına eşittir, dolayısıyla yükü yoktur.

Çözünürlüğü anlayın. Su molekülü (H2O) alışılmadık bir yapıya sahiptir, bu nedenle bir mıknatısa benzer: bir ucu pozitif, diğer ucu negatif yüke sahiptir. Suya iyonik bir bileşik koyduğunuzda, bu su "mıknatısları" çevresinde toplanır ve pozitif ve negatif iyonları ayırmaya çalışır.- Bazı iyonik bileşikler çok sıkı emilmezler, kabul edilirler. çözünür Çünkü suya eklendiğinde parçalanıp çözülür. Diğer bileşikler daha güçlü bağlara sahiptir çözülmez çünkü iyonlar, su molekülünün çekimine bakılmaksızın birbirlerine sıkıca çekilir.
- Bazı bileşikler, bir su molekülünün çekimine eşdeğer bir bağlanma gücüne sahiptir. Hepsi göz önüne alındı az çözünür çünkü çoğu bileşik ayrılacak, ancak geri kalanı yine de birbirini çekecektir.

Tasfiye ilkesini anlayın. Atomlar arasındaki etkileşimler çok karmaşık olduğu için, hangi bileşiklerin yapıp yapamayacağını ayırt etmek için tamamen sezgiye güvenemezsiniz. Ortak özellikleri için aşağıdaki listede yer alan bileşikteki ilk iyona bakın, ardından ikinci iyonun kendisiyle anormal bir şekilde etkileşime girmediğinden emin olmak için istisnaları kontrol edin.- Örneğin, stronsiyum klorürü (SrCl2), lütfen aşağıdaki kalın adımlarda Sr veya Cl arayın. Cl "genellikle çözünür" olduğundan, altındaki istisnaları kontrol edin. Sr istisna listesinde değil, bu yüzden SrCl2 çözülebilir olmalıdır.
- Her kuralın en yaygın istisnaları kuralın altına yazılmıştır. Başka istisnalar da vardır, ancak bunların normal kimya dersi veya laboratuar saatlerinde gerçekleşmesi olası değildir.

Bileşikler Li, Na, K, Rb ve Cs gibi alkali metaller içerdiklerinde çözünürler. Bu metaller aynı zamanda Grup IA elementleri olarak da bilinir: lityum, sodyum, potasyum, rubidyum ve sezyum. Bu iyonlardan birini içeren hemen hemen tüm bileşikler çözünür.- İstisna: Li3PO4 çözünmez.
NO bileşikleri3, C2H3Ö2, HAYIR2, ClO3 ve ClO4 hepsi çözülebilir. Yukarıdaki iyonlara karşılık gelen isimler nitrat, asetat, nitrit, klorat ve perklorattır. Asetatın genellikle OAc olarak kısaltıldığını unutmayın.
- İstisna: Ag (OAc) (gümüş asetat) ve Hg (OAc)2 (cıva asetat) çözünmez.
- AgNO2 ve KClO4 sadece "biraz erimiş".
Cl, Br ve I bileşikleri genellikle çözünürdür. Klorür, bromür ve iyodür iyonları hemen hemen her zaman halojen tuzları adı verilen çözünür bileşikler oluşturur.
- İstisna: Yukarıdaki iyonlardan herhangi biri gümüş iyonları ile birleşirse Ag, civa Hg2veya Pb kurşunu çözünmez bileşikler oluşturacaktır. Aynısı, bakır Cu ve thali Tl ile birleştirildiğinde oluşan daha az yaygın bileşikler için de geçerlidir.
SO içeren bileşikler4 genellikle çözünür. Sülfat iyonları genellikle çözünür bileşikler oluşturur, ancak birçok istisna vardır.
- İstisna: Sülfat iyonları, aşağıdaki iyonlarla çözünmeyen bileşikler oluşturur: stronsiyum Sr, baryum Ba, kurşun Pb, gümüş Ag, kalsiyum Ca, radyum Ra ve Ag gümüş atomları2. Gümüş sülfat ve kalsiyum sülfatın sadece orta derecede çözünür olduğuna dikkat edin, bu nedenle bazıları bunların biraz çözünür olduğunu düşünüyor.
OH veya S içeren maddeler çözünmez. Bu iyonlara karşılık gelen isimler hidroksitler ve sülfitlerdir.
- İstisna: Alkali metalleri (Grup I-A) ve çözünür bileşikler oluşturmayı nasıl sevdiklerini hatırlıyor musunuz? Li, Na, K, Rb ve Cs, hidroksit veya sülfit iyonları ile çözünebilen bileşikler oluşturur. Ek olarak, hidroksitler, alkali toprak metal iyonları (Grup II-A): kalsiyum Ca, stronsiyum Sr ve baryum Ba ile çözünebilen tuzlar oluşturur. Not: Hidroksitlerden ve alkali toprak metallerinden yapılan bileşikler gerçekten de birbirine bağlı kalan önemli sayıda moleküle sahiptir, bu nedenle bazen "az çözünür" olarak kabul edilirler.
CO içeren bileşikler3 veya PO4 çözünmez. Karbonat ve fosfat iyonları için son bir kez kontrol edin ve bileşiğinizin çözünür olup olmadığını göreceksiniz.
- İstisna: Bu iyonlar, Li, Na, K, Rb ve Cs gibi alkali metallerle ve ayrıca amonyum iyonu NH ile çözünebilen bileşikler oluşturur.4.
Yöntem 2/2: Çözünürlüğü K sabitinden hesaplayınsp
Çözünürlük çarpım sabitine bakın Ksp. Bu sabit, her bileşik için farklıdır, bu nedenle bir ders kitabındaki veya çevrimiçi bir grafikte ona bakmalısınız. Bu değerler deneysel olarak belirlendiğinden ve grafikler arasında önemli ölçüde değişebildiğinden, varsa ders kitabının grafiğini kullanmak en iyisidir. Aksi belirtilmedikçe, çoğu grafik 25ºC'lik bir test sıcaklığını varsayar.
- Örneğin, kurşun iyodürü PbI formülüyle çözdüğünüzü varsayalım.2çözünürlük çarpım sabitini yazın. Bilbo.chm.uri.edu'daki grafiğe bakarsanız, 7,1 × 10 sabitini kullanırsınız.
Kimyasal bir denklem yazın. Birincisi, bu bileşiğin çözüldüğünde iyonik ayrılma modelini belirleyin. Sonra denklemi K ile yazınsp bir tarafta ve bileşen iyonları diğer tarafta.
- Örneğin, bir PbI molekülü2 Pb, I ve I iyonlarına ayrışır. (Tüm bileşikler her zaman elektriksel olarak nötr olduğundan, yalnızca bir iyonun yükünü bilmeniz veya kontrol etmeniz gerekir).
- 7,1 × 10 = denklemini yazın
- Bu denklem çözünürlük sabitidir, çözünürlük çizelgesinde 2 iyonu bulabilirsiniz. 2 iyon olduğu için, l- ikinci dereceden olmalıdır.
Değişkenleri kullanmak için denklemleri dönüştürün. Molekül ve iyonların sayısı hakkında bildiğiniz bilgileri kullanarak denklemi normal cebirsel yöntemleri kullanarak yeniden yazın. X'i çözünecek bileşiğin kütlesine eşit olarak ayarlayın ve x'in her iyonun sayısını temsil ettiği denklemi yeniden yazın.
- Bu örnekte, 7,1 × 10 = denklemini yeniden yazmamız gerekiyor.
- Bileşikte sadece bir kurşun iyonu (Pb) olduğu için çözünen molekül sayısı serbest kurşun iyonlarının sayısına eşittir. Dolayısıyla onu x olarak ayarlayabiliriz.
- Her kurşun iyonu için iki iyot iyonu (I) olduğundan, iyot atomlarının sayısını 2x'e eşit olarak ayarladık.
- Şimdi denklem 7.1 × 10 = (x) (2x) olur
Varsa ortak iyonları hesaba katın. Bileşiği damıtılmış suda çözüyorsanız bu adımı atlayın. Bir bileşik, halihazırda bir veya daha fazla bileşen iyonu ("ortak iyonlar") içeren bir çözelti içinde çözülürse, bileşiğin çözünürlüğü önemli ölçüde azalacaktır. Genel iyonların etkisi, neredeyse çözünmez bileşikler üzerinde en belirgin şekilde olacaktır ve bu durumda, denge halindeki iyonların çoğunun daha önce çözelti içinde olanlar olduğunu varsayabilirsiniz. Çözeltide halihazırda bulunan iyonların molar konsantrasyonunu (litre başına mol veya M) hesaplamak için denklemi yeniden yazın, bu değeri o iyon için kullandığınız değişken x ile değiştirin.
- Örneğin, kurşun iyodür bileşiği 0,2 M kurşun klorür (PbCl) çözeltisinde çözülürse2), denklemi 7.1 × 10 = (0.2M + x) (2x) olarak yeniden yazacağız. 0.2M, x'ten daha yüksek bir konsantrasyon olduğundan, onu 7.1 × 10 = (0.2M) (2x) olarak yeniden yazabiliriz.
Denklemi çözün. X'i çözün ve bileşiğin çözünürlüğünü bileceksiniz. Çözünürlük sabiti tanımında, cevabınızı litre su başına çözünen bileşiklerin mol sayısı cinsinden yazmalısınız. Son cevabı bulmak için bilgisayarınızı kullanmanız gerekebilir.
- Aşağıdaki örnek, herhangi bir ortak iyon olmaksızın damıtılmış sudaki çözünürlüktür.
- 7,1 × 10 = (x) (2x)
- 7,1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = Litre başına 1,2 x 10 mol çözülür. Bu çok küçük bir kütledir, bu nedenle bu bileşik neredeyse çözünmezdir.
Neye ihtiyacın var
- Bileşiğin çözünürlük ürün sabitleri tablosu (Ksp)
Tavsiye
- Çözünen bileşiklerin miktarı hakkında deneysel verileriniz varsa, çözünürlük sabiti K'yi çözmek için aynı denklemi kullanabilirsiniz.sp.
Uyarı
- Bu terimlerin tanımları üzerinde fikir birliği yoktur, ancak kimyagerler bileşiklerin çoğu üzerinde hemfikirdir. Hem çözünür hem de çözünmez moleküllerin, her biri bu bileşiklerin farklı bir tanımına sahip önemli bileşenleri oluşturduğu bir dizi özel bileşik.
- Bazı eski ders kitapları NH4OH, çözünür bir bileşiktir. Bu doğru değil; Küçük miktarlarda NH iyonları tespit edildi4 ve OH, ancak bu iki iyon bileşikler halinde birleşemez.