Yazar:
Virginia Floyd
Yaratılış Tarihi:
6 Ağustos 2021
Güncelleme Tarihi:
1 Temmuz 2024
İçerik
- adımlar
- Yöntem 1/3: Temel Bilgiler
- Yöntem 2/3: Elektronegatiflik ile bağ türünü belirleme
- Yöntem 3/3: Mulliken Elektronegativitesinin Hesaplanması
- İpuçları
Kimyada elektronegatiflik, atomların diğer atomlardan elektronları kendilerine çekme yeteneğidir. Elektronegatifliği yüksek bir atom elektronları güçlü bir şekilde çeker ve düşük elektronegatifliğe sahip bir atom elektronları zayıf çeker. Elektronegatiflik değerleri, kimyasal bileşiklerdeki çeşitli atomların davranışını tahmin etmek için kullanılır.
adımlar
Yöntem 1/3: Temel Bilgiler
 1 Kimyasal bağlar. Bu tür bağlar, atomlardaki elektronlar birbirleriyle etkileştiğinde ortaya çıkar, yani iki elektron (her atomdan bir tane) ortak hale gelir.
1 Kimyasal bağlar. Bu tür bağlar, atomlardaki elektronlar birbirleriyle etkileştiğinde ortaya çıkar, yani iki elektron (her atomdan bir tane) ortak hale gelir. - Atomlardaki elektronların etkileşiminin nedenlerinin açıklaması bu makalenin kapsamı dışındadır.Bu konu hakkında daha fazla bilgi için, örneğin bu makaleyi okuyun.
 2 Elektronegatifliğin etkisi. İki atom birbirinin elektronlarını çektiğinde, çekim kuvveti aynı değildir. Elektronegatifliği daha yüksek olan bir atom iki elektronu daha güçlü bir şekilde çeker. Elektronegatifliği çok yüksek olan bir atom elektronları öyle bir kuvvetle çeker ki artık paylaşılan elektronlardan bahsetmiyoruz.
2 Elektronegatifliğin etkisi. İki atom birbirinin elektronlarını çektiğinde, çekim kuvveti aynı değildir. Elektronegatifliği daha yüksek olan bir atom iki elektronu daha güçlü bir şekilde çeker. Elektronegatifliği çok yüksek olan bir atom elektronları öyle bir kuvvetle çeker ki artık paylaşılan elektronlardan bahsetmiyoruz. - Örneğin, NaCl molekülünde (sodyum klorür, adi tuz), klor atomunun elektronegatifliği oldukça yüksektir ve sodyum atomu oldukça düşüktür. yani elektronlar klor atomuna çekilir ve sodyum atomlarını itmek.
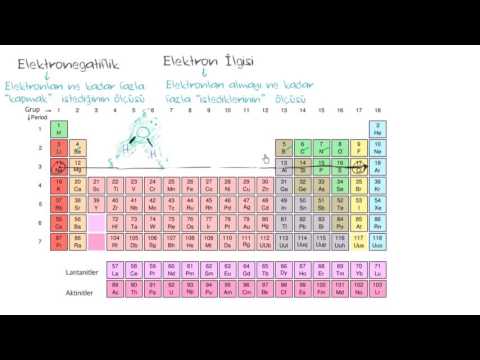
 3 Elektronegatiflik tablosu. Bu tablo, periyodik tablodakiyle aynı şekilde düzenlenmiş kimyasal elementleri içerir, ancak her element için atomlarının elektronegatifliği verilir. Böyle bir tablo kimya ders kitaplarında, referans materyallerde ve internette bulunabilir.
3 Elektronegatiflik tablosu. Bu tablo, periyodik tablodakiyle aynı şekilde düzenlenmiş kimyasal elementleri içerir, ancak her element için atomlarının elektronegatifliği verilir. Böyle bir tablo kimya ders kitaplarında, referans materyallerde ve internette bulunabilir. - Burada mükemmel bir elektronegatiflik tablosu bulacaksınız. En yaygın olan Pauling elektronegatiflik ölçeğini kullandığını unutmayın. Bununla birlikte, biri aşağıda tartışılacak olan elektronegatifliği hesaplamanın başka yolları da vardır.
 4 Elektronegatiflik eğilimleri. Elinizde bir elektronegatiflik tablonuz yoksa, bir elementin periyodik tablodaki konumuna göre bir atomun elektronegatifliğini tahmin edebilirsiniz.
4 Elektronegatiflik eğilimleri. Elinizde bir elektronegatiflik tablonuz yoksa, bir elementin periyodik tablodaki konumuna göre bir atomun elektronegatifliğini tahmin edebilirsiniz. - Nasıl Sağa eleman bulunur, daha fazla atomunun elektronegatifliği.
- Nasıl daha yüksek eleman bulunur, daha fazla atomunun elektronegatifliği.
- Böylece periyodik tablonun sağ üst köşesinde yer alan elementlerin atomları en yüksek elektronegatifliğe sahipken, sol alt köşede bulunan elementlerin atomları en düşük elektronegatifliğe sahiptir.
- NaCl örneğimizde klorun sodyumdan daha yüksek bir elektronegatifliğe sahip olduğunu söyleyebiliriz, çünkü klor sodyumun sağında yer alır.
Yöntem 2/3: Elektronegatiflik ile bağ türünü belirleme
 1 Aralarındaki bağın özelliklerini anlamak için iki atomun elektronegatiflikleri arasındaki farkı hesaplayın. Bunu yapmak için, küçük elektronegatifliği büyük olandan çıkarın.
1 Aralarındaki bağın özelliklerini anlamak için iki atomun elektronegatiflikleri arasındaki farkı hesaplayın. Bunu yapmak için, küçük elektronegatifliği büyük olandan çıkarın. - Örneğin, HF molekülünü düşünün. Hidrojenin (2.1) elektronegatifliğini florin (4.0) elektronegatifliğinden çıkarın: 4.0 - 2.1 = 1,9.
 2 Fark 0,5'ten küçükse, bağ, elektronların hemen hemen aynı kuvvetle çekildiği kovalent polar değildir. Bu tür bağlar iki özdeş atom arasında oluşur. Polar olmayan bağlantıların kırılması genellikle çok zordur. Bunun nedeni, atomların elektronları paylaşması ve bu da bağlarını kararlı hale getirmesidir. Onu yok etmek için çok fazla enerji gerekir.
2 Fark 0,5'ten küçükse, bağ, elektronların hemen hemen aynı kuvvetle çekildiği kovalent polar değildir. Bu tür bağlar iki özdeş atom arasında oluşur. Polar olmayan bağlantıların kırılması genellikle çok zordur. Bunun nedeni, atomların elektronları paylaşması ve bu da bağlarını kararlı hale getirmesidir. Onu yok etmek için çok fazla enerji gerekir. - Örneğin, O molekülü2 bu tür bir bağlantıya sahiptir. İki oksijen atomunun elektronegatifliği aynı olduğundan aralarındaki fark 0'dır.
 3 Fark 0,5 - 1,6 aralığındaysa, bağ kovalent polardır. Bu durumda, iki atomdan biri elektronları daha güçlü bir şekilde çeker ve bu nedenle kısmi negatif yük ve diğeri kısmi pozitif yük alır. Bu yük dengesizliği, molekülün belirli reaksiyonlara katılmasına izin verir.
3 Fark 0,5 - 1,6 aralığındaysa, bağ kovalent polardır. Bu durumda, iki atomdan biri elektronları daha güçlü bir şekilde çeker ve bu nedenle kısmi negatif yük ve diğeri kısmi pozitif yük alır. Bu yük dengesizliği, molekülün belirli reaksiyonlara katılmasına izin verir. - Örneğin, H molekülü2O (su) bu tip bir bağa sahiptir. O atomu iki H atomundan daha elektronegatiftir, bu nedenle oksijen elektronları daha güçlü bir şekilde çeker ve kısmi bir negatif yük ve hidrojen - kısmi bir pozitif yük alır.
 4 Fark 2.0'dan büyükse, bağ iyoniktir. Bu, ortak elektron çiftinin ağırlıklı olarak daha yüksek elektronegatifliğe sahip bir atoma geçtiği ve negatif bir yük kazandığı ve elektronegatifliği daha düşük olan bir atomun pozitif bir yük kazandığı bir bağdır. Bu tür bağlara sahip moleküller, diğer atomlarla iyi reaksiyona girer ve hatta polar atomlar tarafından yok edilebilir.
4 Fark 2.0'dan büyükse, bağ iyoniktir. Bu, ortak elektron çiftinin ağırlıklı olarak daha yüksek elektronegatifliğe sahip bir atoma geçtiği ve negatif bir yük kazandığı ve elektronegatifliği daha düşük olan bir atomun pozitif bir yük kazandığı bir bağdır. Bu tür bağlara sahip moleküller, diğer atomlarla iyi reaksiyona girer ve hatta polar atomlar tarafından yok edilebilir. - Örneğin, NaCl (sodyum klorür) molekülü bu tip bir bağa sahiptir.Klor atomu o kadar elektronegatiftir ki her iki elektronu da kendine çekerek negatif yük, sodyum atomu ise pozitif yük alır.
- NaCl, H2O (su) gibi bir polar molekül tarafından yok edilebilir. Bir su molekülünde molekülün hidrojen tarafı pozitif, oksijen tarafı negatiftir. Tuzu suyla karıştırırsanız, su molekülleri tuz moleküllerini parçalayarak çözünmesine neden olur.
 5 Fark 1,6 ile 2,0 arasındaysa, metal olup olmadığını kontrol edin. Bir molekülde bir metal atomu varsa, bağ iyoniktir. Molekülde metal atomu yoksa bağ polar kovalenttir.
5 Fark 1,6 ile 2,0 arasındaysa, metal olup olmadığını kontrol edin. Bir molekülde bir metal atomu varsa, bağ iyoniktir. Molekülde metal atomu yoksa bağ polar kovalenttir. - Metaller periyodik tablonun solunda ve ortasında yer alır. Bu tabloda metaller vurgulanmıştır.
- HF örneğimizde, elektronegatiflikler arasındaki fark bu aralığa düşer. H ve F metal olmadığından bağ Kutupsal kovalent.
Yöntem 3/3: Mulliken Elektronegativitesinin Hesaplanması
 1 Bir atomun ilk iyonlaşma enerjisini bulun. Mulliken elektronegatiflik ölçeği, yukarıda bahsedilen Pauling ölçeğinden biraz farklıdır. Bir elektrondan bir atomu koparmak için ilk iyonlaşma enerjisi gereklidir.
1 Bir atomun ilk iyonlaşma enerjisini bulun. Mulliken elektronegatiflik ölçeği, yukarıda bahsedilen Pauling ölçeğinden biraz farklıdır. Bir elektrondan bir atomu koparmak için ilk iyonlaşma enerjisi gereklidir. - Bu tür enerjinin anlamı, örneğin burada, kimya referans kitaplarında veya internette bulunabilir.
- Örnek olarak, lityumun (Li) elektronegatifliğini bulalım. İlk iyonlaşma enerjisi, 520 kJ / mol.
 2 Bir elektronun ilgi enerjisini bulun. Bu, bir elektronun bir atoma bağlanması sürecinde açığa çıkan enerjidir. Bu tür enerjinin anlamı, örneğin burada, kimya referans kitaplarında veya internette bulunabilir.
2 Bir elektronun ilgi enerjisini bulun. Bu, bir elektronun bir atoma bağlanması sürecinde açığa çıkan enerjidir. Bu tür enerjinin anlamı, örneğin burada, kimya referans kitaplarında veya internette bulunabilir. - Lityumun elektron ilgi enerjisi, 60 kJ / mol.
 3 Mulliken'in elektronegatiflik denklemini kullanın:RUmulliken = (1.97 × 10) (Eben+ Eea) + 0,19.
3 Mulliken'in elektronegatiflik denklemini kullanın:RUmulliken = (1.97 × 10) (Eben+ Eea) + 0,19. - Örneğimizde:
- RUmulliken = (1.97 × 10) (Eben+ Eea) + 0,19
- RUmulliken = (1,97×10)(520 + 60) + 0,19
- RUmulliken = 1,143 + 0,19 = 1,333
- Örneğimizde:
İpuçları
- Pauling ve Mulliken ölçeklerine ek olarak, Allred-Rochow, Sanderson, Allen'a göre elektronegatiflik ölçekleri vardır. Hepsinin elektronegatifliği hesaplamak için kendi formülleri vardır (bazıları oldukça karmaşıktır).
- Elektronegatifliğin ölçü birimi yoktur.