Yazar:
Florence Bailey
Yaratılış Tarihi:
21 Mart 2021
Güncelleme Tarihi:
1 Temmuz 2024
İçerik
- adımlar
- Yöntem 1/2: D. I. Mendeleev'in periyodik sistemini kullanarak elektronların dağılımı
- Yöntem 2/2: ADOMAH Periyodik Tablosunu Kullanma
- İpuçları
Elektronik konfigürasyon bir atom, elektron yörüngelerinin sayısal bir temsilidir. Elektronik orbitaller, bir elektronun matematiksel olarak muhtemel olduğu bir atom çekirdeğinin etrafında yer alan çeşitli şekillerdeki bölgelerdir. Elektronik konfigürasyon, okuyucuya bir atomun kaç elektron orbitaline sahip olduğunu hızlı ve kolay bir şekilde söylemeye ve her orbitaldeki elektron sayısını belirlemeye yardımcı olur. Bu makaleyi okuduktan sonra, elektronik konfigürasyon oluşturma yöntemine hakim olacaksınız.
adımlar
Yöntem 1/2: D. I. Mendeleev'in periyodik sistemini kullanarak elektronların dağılımı
 1 Atomunuzun atom numarasını bulun. Her atomun kendisiyle ilişkili belirli sayıda elektronu vardır. Periyodik tablodaki atomunuzun sembolünü bulun. Bir atom numarası, 1'den (hidrojen için) başlayan ve sonraki her atom için bir artan pozitif bir tamsayıdır. Atom numarası, bir atomdaki proton sayısıdır ve bu nedenle, aynı zamanda sıfır yüklü bir atomdaki elektronların sayısıdır.
1 Atomunuzun atom numarasını bulun. Her atomun kendisiyle ilişkili belirli sayıda elektronu vardır. Periyodik tablodaki atomunuzun sembolünü bulun. Bir atom numarası, 1'den (hidrojen için) başlayan ve sonraki her atom için bir artan pozitif bir tamsayıdır. Atom numarası, bir atomdaki proton sayısıdır ve bu nedenle, aynı zamanda sıfır yüklü bir atomdaki elektronların sayısıdır. - 2 Bir atomun yükünü belirleyin. Nötr atomlar, periyodik tabloda gösterildiği gibi aynı sayıda elektrona sahip olacaktır. Bununla birlikte, yüklü atomlar, yüklerinin miktarına bağlı olarak daha fazla veya daha az elektrona sahip olacaktır. Yüklü bir atomla çalışıyorsanız, elektronları aşağıdaki gibi ekleyin veya çıkarın: her negatif yük için bir elektron ekleyin ve her pozitif yük için bir elektron çıkarın.
- Örneğin, yükü -1 olan bir sodyum atomunun fazladan bir elektronu olacaktır. ek olarak temel atom numarası 11'e. Başka bir deyişle, toplam atomun 12 elektronu olacaktır.
- +1 yüklü bir sodyum atomundan bahsediyorsak, temel atom numarası 11'den bir elektron çıkarılmalıdır. Böylece atom 10 elektrona sahip olacaktır.
- 3 Yörüngelerin temel listesini hatırlayın. Elektron sayısı arttıkça atomun elektron kabuğunun çeşitli alt katmanlarını belirli bir sıraya göre doldururlar. Elektron kabuğunun her alt seviyesi, doldurulduğunda çift sayıda elektron içerir. Aşağıdaki alt düzeyler mevcuttur:
- s-alt düzey ("s" harfinden önce gelen elektronik konfigürasyondaki herhangi bir sayı tek bir yörünge içerir ve buna göre Pauli ilkesi, bir yörünge maksimum 2 elektron içerebilir, bu nedenle elektron kabuğunun her s-alt seviyesinde 2 elektron olabilir.
- p-alt seviye 3 orbital içerir ve bu nedenle maksimum 6 elektron içerebilir.
- d-alt seviye 5 orbital içerir, bu nedenle 10 elektrona sahip olabilir.
- f-alt seviye 7 orbital içerir, bu nedenle 14 elektrona sahip olabilir.
- g-, h-, i- ve k-alt seviyeleri teorik vardır. Bu orbitallerde elektron içeren atomlar bilinmemektedir. G-alt seviyesi 9 orbital içerir, yani teorik olarak 18 elektrona sahip olabilir. h-alt seviyesi 11 orbitale ve maksimum 22 elektrona sahip olabilir; i-alt seviyede -13 orbital ve maksimum 26 elektron; k-alt seviyesinde - 15 orbital ve maksimum 30 elektron.
- Anımsatıcı numarayı kullanarak yörüngelerin sırasını ezberleyin:
Sober Pfizikçiler NSüzerinde Find Giraffeler Htanımlama benn Kkaşınıyor (ayık fizikçiler mutfaklarda saklanan zürafaları bulamıyorlar).
- 4 Elektronik konfigürasyon kaydını anlayın. Elektronik konfigürasyonlar, her orbitaldeki elektron sayısını net bir şekilde yansıtacak şekilde kaydedilir. Yörüngeler, her yörüngedeki atom sayısı yörünge adının sağında üst simge olacak şekilde sırayla yazılır. Tamamlanan elektronik konfigürasyon, bir dizi alt seviye atamaları ve üst simgeler şeklini alır.
- Örneğin, en basit elektronik konfigürasyon: 1s 2s 2p. Bu konfigürasyon, 1s alt seviyesinde iki elektron, 2s alt seviyesinde iki elektron ve 2p alt seviyesinde altı elektron olduğunu gösterir. 2 + 2 + 6 = toplamda 10 elektron. Bu, nötr bir neon atomunun elektronik konfigürasyonudur (neon atom numarası 10'dur).
- 5 Yörüngelerin sırasını hatırla. Elektron orbitallerinin, elektron kabuğu numarasının artan sırasına göre, ancak artan enerji sırasına göre numaralandırıldığını unutmayın. Örneğin, doldurulmuş bir 4s yörüngesi kısmen doldurulmuş veya doldurulmuş bir 3d'den daha az enerjiktir (veya daha az hareketlidir), bu nedenle önce 4s yörüngesi kaydedilir. Yörüngelerin sırasını öğrendikten sonra, atomdaki elektron sayısına göre bunları kolayca doldurabilirsiniz. Yörüngeleri doldurma sırası aşağıdaki gibidir: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Tüm yörüngelerin doldurulduğu bir atomun elektronik konfigürasyonu şu şekilde olacaktır: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Yukarıdaki girişin, tüm orbitaller dolduğunda, periyodik tablodaki en yüksek numaralı atom olan Uuo (ununoktiyum) 118 elementinin elektronik konfigürasyonu olduğuna dikkat edin. Bu nedenle, bu elektronik konfigürasyon, nötr yüklü bir atomun şu anda bilinen tüm elektronik alt seviyelerini içerir.
- 6 Atomunuzdaki elektron sayısına göre orbitalleri doldurun. Örneğin, nötr bir kalsiyum atomunun elektronik konfigürasyonunu yazmak istiyorsak, işe periyodik tablodaki atom numarasını arayarak başlamalıyız. Atom numarası 20'dir, bu yüzden 20 elektronlu bir atomun konfigürasyonunu yukarıdaki sıraya göre yazacağız.
- Yirminci elektrona ulaşana kadar orbitalleri yukarıdaki sırayla doldurun. İlk 1s orbitali iki elektron içerecek, 2s orbitalleri de iki, 2p - altı, 3s - iki, 3p - 6 ve 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20) olacaktır. başka bir deyişle, kalsiyumun elektronik konfigürasyonu: 1s 2s 2p 3s 3p 4s.
- Yörüngelerin artan enerji düzeninde olduğuna dikkat edin. Örneğin, 4. enerji seviyesine geçmeye hazır olduğunuzda, önce 4s yörüngesini yazın ve Daha sonra 3 boyutlu. Dördüncü enerji seviyesinden sonra aynı düzenin tekrarlandığı beşinci enerji seviyesine geçersiniz. Bu ancak üçüncü enerji seviyesinden sonra olur.
- 7 Görsel ipucu olarak periyodik tabloyu kullanın. Periyodik tablonun şeklinin elektronik konfigürasyonlardaki elektronik alt seviyelerin sırasına karşılık geldiğini muhtemelen fark etmişsinizdir. Örneğin, soldan ikinci sütundaki atomlar her zaman "s" ile biterken, ince orta bölümün sağ kenarındaki atomlar her zaman "d" ile biter vb. Periyodik tabloyu konfigürasyonları yazmak için görsel bir kılavuz olarak kullanın - orbitallere eklediğiniz sıra tablodaki konumunuza karşılık geldiğinden. Aşağıya bakınız:
- Özellikle, en soldaki iki sütun, elektronik konfigürasyonları s-orbitalleri ile biten atomları, tablonun sağ bloğu konfigürasyonları p-orbitalleri ile biten atomları ve alt kısımda, atomları f-orbitalleri ile biten atomları içerir.
- Örneğin klorun elektronik konfigürasyonunu yazarken şöyle düşünün: "Bu atom periyodik tablonun üçüncü satırında (veya" periyodunda ") bulunur. Ayrıca p orbital bloğunun beşinci grubunda yer alır. periyodik sistemin.Bu nedenle, elektronik konfigürasyonu sona erecektir. ..3p
- Lütfen dikkat: Tablonun d ve f orbitalleri bölgesindeki elementler, bulundukları periyoda karşılık gelmeyen enerji seviyeleri ile karakterize edilir. Örneğin, d-orbitalleri olan elementler bloğunun ilk satırı, 4. periyotta yer almasına rağmen 3d orbitallerine karşılık gelir ve f-orbitalleri olan ilk element sırası, 4f orbitaline karşılık gelmesine rağmen, 4f orbitaline karşılık gelir. 6. periyottadır.
- 8 Uzun elektronik konfigürasyonlar yazmanın kısa yolunu öğrenin. Periyodik tablonun sağ kenarında bulunan atomlara denir. soy gazlar. Bu elementler kimyasal olarak çok kararlıdır. Uzun elektronik konfigürasyonlar yazma sürecini kısaltmak için, atomunuzdan daha az elektrona sahip en yakın soy gazın kimyasal sembolünü köşeli parantezler içinde yazmanız ve ardından sonraki yörünge seviyelerinin elektronik konfigürasyonunu yazmaya devam etmeniz yeterlidir. Aşağıya bakınız:
- Bu kavramı anlamak için örnek bir konfigürasyon yazmak faydalı olacaktır. Asil gaz kısaltmasını kullanarak çinko (atom numarası 30) konfigürasyonunu yazalım. Tam çinko konfigürasyonu şöyle görünür: 1s 2s 2p 3s 3p 4s 3d. Ancak 1s 2s 2p 3s 3p'nin bir soy gaz olan argonun elektronik konfigürasyonu olduğunu görüyoruz. Basitçe çinkonun elektronik konfigürasyon kısmını köşeli parantez ([Ar]) içindeki kimyasal sembol argon ile değiştirin.
- Bu nedenle, kısaltılmış bir biçimde yazılmış çinkonun elektronik konfigürasyonu şöyledir: [Ar] 4s 3d.
- Bir soy gazın elektronik konfigürasyonunu yazıyorsanız, örneğin argon, [Ar] yazamazsınız! Bu elemente bakan soy gazın indirgenmesi kullanılmalıdır; argon için neon ([Ne]) olacaktır.
Yöntem 2/2: ADOMAH Periyodik Tablosunu Kullanma
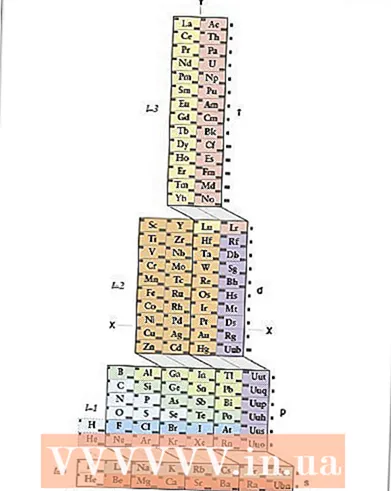
 1 ADOMAH periyodik tablosunu öğrenin. Elektronik konfigürasyonu kaydetmeye yönelik bu yöntem ezberleme gerektirmez, ancak revize edilmiş bir periyodik tablo gerektirir, çünkü geleneksel periyodik tabloda dördüncü periyottan başlayarak periyot numarası elektron kabuğuna karşılık gelmez. ADOMAH Periyodik Tablosunu bulun - bilim adamı Valery Zimmerman tarafından geliştirilen özel bir periyodik tablo türü. İnternette kısa bir arama ile bulmak kolaydır.
1 ADOMAH periyodik tablosunu öğrenin. Elektronik konfigürasyonu kaydetmeye yönelik bu yöntem ezberleme gerektirmez, ancak revize edilmiş bir periyodik tablo gerektirir, çünkü geleneksel periyodik tabloda dördüncü periyottan başlayarak periyot numarası elektron kabuğuna karşılık gelmez. ADOMAH Periyodik Tablosunu bulun - bilim adamı Valery Zimmerman tarafından geliştirilen özel bir periyodik tablo türü. İnternette kısa bir arama ile bulmak kolaydır. - ADOMAH'ın periyodik tablosunda yatay sıralar halojenler, soy gazlar, alkali metaller, toprak alkali metaller vb. gibi element gruplarını temsil eder. Dikey sütunlar elektronik seviyelere karşılık gelir ve sözde "kaskadlar" (s, p, d ve f bloklarını birbirine bağlayan çapraz çizgiler) periyotlara karşılık gelir.
- Helyum, bu elementlerin her ikisi de 1s yörüngesine sahip olduğu için hidrojene taşınır. Periyot blokları (s, p, d ve f) sağ tarafta gösterilir ve seviye numaraları altta gösterilir. Elementler 1'den 120'ye kadar numaralandırılmış kutularda gösterilmiştir. Bu sayılar, nötr bir atomdaki toplam elektron sayısını temsil eden yaygın atom numaralarıdır.
- 2 ADOMAH tablosunda atomunuzu bulun. Bir elementin elektronik konfigürasyonunu kaydetmek için ADOMAH periyodik tablosundaki sembolünü bulun ve daha yüksek atom numarasına sahip tüm elementlerin üzerini çizin. Örneğin, erbiyumun (68) elektronik konfigürasyonunu yazmanız gerekiyorsa, 69'dan 120'ye kadar tüm öğelerin üzerini çizin.
- Tablonun altındaki 1'den 8'e kadar olan sayıları not edin. Bunlar elektronik seviye numaraları veya sütun numaralarıdır. Yalnızca üstü çizili öğeleri içeren sütunları yoksay.Erbiyum için 1, 2, 3, 4, 5 ve 6 numaralı sütunlar kalır.
- 3 Elemanınızın yörünge alt seviyelerini sayın. Tablonun sağında gösterilen blok sembollerine (s, p, d ve f) ve altta gösterilen sütun numaralarına bakarak, bloklar arasındaki çapraz çizgileri görmezden gelin ve sütunları alttan sırayla sütun bloklarına ayırın. en üste. Yine, tüm öğelerin üstü çizili kutuları görmezden gelin. Sütun numarasından başlayarak blok sembolünü takip ederek sütun bloklarını yazın: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (erbium için).
- Not: Yukarıdaki elektronik konfigürasyon Er, elektronik alt seviye numarasına göre artan sırada yazılır. Yörüngeleri doldurma sırasına göre de yazılabilir. Bunu yapmak için sütun bloklarını yazarken sütunları değil, aşağıdan yukarıya doğru basamakları takip edin: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Her elektronik alt seviye için elektronları sayın. Her bir blok-sütunda üzeri çizilmemiş olan elementleri, her elementten bir elektron ekleyerek sayın ve numaralarını her blok-sütun için blok sembolünün yanına aşağıdaki gibi yazın: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s... Örneğimizde bu, erbiyumun elektronik konfigürasyonudur.
- 5 Yanlış elektronik konfigürasyonları düşünün. Temel enerji durumu olarak da adlandırılan en düşük enerji durumundaki atomların elektronik konfigürasyonlarıyla ilgili on sekiz tipik istisna vardır. Sadece elektronların işgal ettiği son iki veya üç pozisyonda genel kurala uymazlar. Bu durumda, gerçek elektronik konfigürasyon, elektronların, atomun standart konfigürasyonuna kıyasla daha düşük enerjili bir durumda olduğunu varsayar. İstisna atomları şunları içerir:
- cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); not (..., 4d4, 5s1); ay (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); PD (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); CE (..., 4f1, 5d1, 6s2); gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); AC (..., 6d1, 7s2); NS (..., 6d2, 7s2); baba (..., 5f2, 6d1, 7s2); sen (..., 5f3, 6d1, 7s2); np (..., 5f4, 6d1, 7s2) ve Santimetre (..., 5f7, 6d1, 7s2).
İpuçları
- Elektronik konfigürasyonda yazıldığında bir atomun atom numarasını bulmak için (s, p, d ve f) harflerini takip eden tüm sayıları toplamanız yeterlidir. Bu sadece nötr atomlar için işe yarar, eğer bir iyonla uğraşıyorsanız, o zaman hiçbir şey işe yaramaz - ekstra veya kayıp elektron sayısını eklemeniz veya çıkarmanız gerekir.
- Harfi takip eden sayı bir üst simgedir, kontrolde hata yapmayın.
- "Yarı dolu bir alt seviyenin kararlılığı" yoktur. Bu bir sadeleştirmedir. "Yarı dolu" alt düzeylerle ilgili herhangi bir kararlılık, her yörüngenin bir elektron tarafından işgal edilmesi gerçeğinden kaynaklanır, bu nedenle elektronlar arasındaki itme en aza indirilir.
- Her atom kararlı bir duruma eğilim gösterir ve en kararlı konfigürasyonlar s ve p (s2 ve p6) alt seviyelerini doldurmuştur. Soy gazlar böyle bir konfigürasyona sahiptir, bu nedenle nadiren reaksiyonlara girerler ve periyodik tablonun sağında bulunurlar. Bu nedenle, konfigürasyon 3p'de biterse, kararlı bir duruma ulaşmak için iki elektrona ihtiyaç duyar (s-alt seviyesinin elektronları dahil altı kaybetmek için daha fazla enerji gerekir, bu nedenle dört kaybetmek daha kolaydır). Ve konfigürasyon 4d'de biterse, kararlı bir duruma ulaşmak için üç elektron kaybetmesi gerekir. Ek olarak, yarı dolu alt düzeyler (s1, p3, d5 ..), örneğin p4 veya p2'den daha kararlıdır; ancak, s2 ve p6 daha da sağlam olacaktır.
- Bir iyonla uğraşırken bu, proton sayısının elektron sayısına eşit olmadığı anlamına gelir. Bu durumda, bir atomun yükü kimyasal sembolün sağ üst köşesinde (kural olarak) gösterilecektir. Bu nedenle +2 yüklü bir antimon atomu 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p elektronik konfigürasyonuna sahiptir. 5p'nin 5p olarak değiştirildiğini unutmayın. Nötr bir atomun konfigürasyonu s ve p dışındaki alt seviyelerde sona erdiğinde dikkatli olun. Elektronları aldığınızda, onları yalnızca değerlik orbitallerinden (s ve p orbitalleri) alabilirsiniz.Bu nedenle, konfigürasyon 4s 3d'de biterse ve atom +2 yük kazanırsa, konfigürasyon 4s 3d'de sona erecektir. 3d olduğunu lütfen unutmayın olumsuzluk s-orbital elektronlarını kaybetmek yerine değişir.
- Elektronun "daha yüksek bir enerji seviyesine gitmeye" zorlandığı durumlar vardır. Bir alt seviyede bir elektron yarıya kadar veya tam doluma sahip değilse, en yakın s veya p alt seviyesinden bir elektron alın ve onu bir elektrona ihtiyaç duyan alt seviyeye taşıyın.
- Bir elektronik konfigürasyonu kaydetmek için iki seçenek vardır. Yukarıda erbium için gösterildiği gibi, artan enerji düzeyi sayıları sırasına veya elektron orbitallerini doldurma sırasına göre yazılabilirler.
- Bir elemanın elektronik konfigürasyonunu sadece son s ve p alt seviyeleri olan değerlik konfigürasyonunu yazarak da yazabilirsiniz. Böylece, antimonun değerlik konfigürasyonu 5s 5p formuna sahip olacaktır.
- Jonah aynı değil. Onlarla çok daha zor. İki seviye atlayın ve başladığınız yere ve elektron sayısının ne kadar büyük olduğuna bağlı olarak aynı modeli takip edin.