Yazar:
John Stephens
Yaratılış Tarihi:
27 Ocak Ayı 2021
Güncelleme Tarihi:
1 Temmuz 2024
İçerik
Kimyada, elektronegatiflik kimyasal bağda bir atomun elektrona olan çekimini ölçen birimdir. Elektronegatifliği yüksek atomlar güçlü kuvvetle elektronları çekerken, düşük elektronegatifliğe sahip atomlar zayıf kuvvetle elektronları çekecektir. Elektronegatiflik değerleri, atomlar arasında kimyasal bağlar oluşturma yeteneğini tahmin etmek için kullanılır, bu nedenle bu, temel kimyada önemli bir beceridir.
Adımlar
Yöntem 1/3: Temel elektronegatiflik bilgisi
Kimyasal bağ, atomlar elektron paylaştığında ortaya çıkar. Elektronegatifliği anlamak için önce "bağlanmanın" ne olduğunu anlamalısınız. Moleküler yapıda birbirine "bağlı" olan herhangi iki atom, aralarında bir bağ olacaktır, yani bir çift elektron paylaşırlar ve her atom bu bağa bir elektron katkıda bulunur.
- Bu makale kesin nedeni kapsamıyor neden atomlar elektronları paylaşır ve aralarında bir bağ vardır. Daha fazla bilgi edinmek istiyorsanız, kimyasal bağla ilgili bu makaleyi veya wikiHow'un kimyasal bağ özelliklerini inceleme konulu makalesini okuyun.

Elektronegatiflik bağdaki elektronları nasıl etkiler? İki atom bağda aynı elektron çiftini paylaştığında, bu pay her zaman dengede değildir. Bir atom diğerinden daha yüksek bir elektronegatifliğe sahip olduğunda, bağdaki iki elektronu kendisine yaklaştırır. Bir atom, elektronları neredeyse tamamen kendisine doğru çekebilen çok yüksek bir elektronegatifliğe sahiptir ve elektronları diğer atomla neredeyse hiç paylaşmaz.- Örneğin, NaCl (sodyum klorür) molekülünde, klor atomu nispeten yüksek bir elektronegatifliğe sahiptir ve sodyum atomu nispeten düşük bir elektronegatifliğe sahiptir. Dolayısıyla elektronlar çekilir klor atomuna doğru ve sodyum atomlarından uzakta.

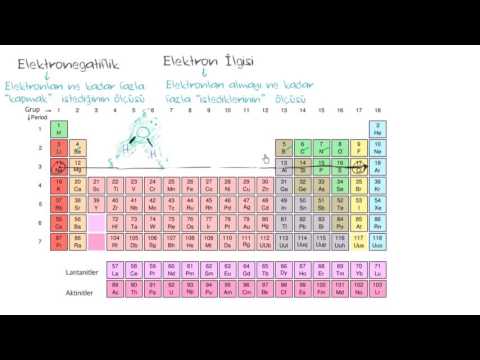
Referans için elektronegatiflik tablosunu kullanın. Elektronegatiflik tablosunda kimyasal elementler tam olarak periyodik tablodaki gibi düzenlenir, ancak elektronegatiflik her bir atoma kaydedilir. Bu çizelge birçok kimya ders kitabında, teknik literatürde veya internette basılmıştır.- Bu, elektronegatiflik kontrol cihazına götüren bağlantıdır. Bu tablonun en yaygın elektronegatiflik ölçeği olan Pauling ölçeğini kullandığını unutmayın. Bununla birlikte, elektronegatifliği ölçmenin başka yolları da vardır ve bunlardan biri aşağıda özetlenecektir.

Atomlar, kolay tahmin için elektronegatiflikte düzenlenmiştir. Bir elektronegatiflik çizelgeniz yoksa, bir atomun elektronegatifliğini normal bir kimyasal periyodik tablodaki konumuna göre tahmin edebilirsiniz. Genel bir kural olarak:- Atomun elektronegatifliği yavaş yavaş daha yüksek devam ettiğinde doğru periyodik tablo.
- Atomun elektronegatifliği yavaş yavaş daha yüksek hareket ederken yukarı git periyodik tablo.
- Bu nedenle, sağ üst köşedeki atomlar en yüksek elektronegatifliğe ve sol alt köşedeki atomlar en düşük elektronegatifliğe sahiptir.
- Yukarıdaki NaCl örneğinde, klorun, periyodik tablonun sağ üst köşesine çok yakın olduğu için sodyumdan daha yüksek bir elektronegatifliğe sahip olduğunu söyleyebilirsiniz. Buna karşılık, sodyum solda olduğundan düşük elektronegatifliğe sahip atomlar grubuna aittir.
Yöntem 2/3: Elektronegatiflik ile bağ türünü belirleyin
İki atom arasındaki elektronegatiflik farkını bulun. İki atom bağlandığında, iki atom arasındaki elektronegatiflik farkı size bu bağın özelliklerini söyleyebilir. Farkı bulmak için küçük elektronegatifliği küçük elektronegatiflikten çıkarın.
- Örnek olarak HF molekülünü alarak, hidrojenin (2,1) elektronegatifliği için florin (4,0) elektronegatifliğini çıkaracağız. 4.0 - 2.1 = 1,9.
Elektronegatiflik farkı yaklaşık 0,5'ten azsa, bağ, elektronların neredeyse eşit olarak paylaşıldığı polar olmayan kovalent bir bağdır. Bu tür bir bağ, bağın uçları arasında büyük bir yük farkı olan bir molekül oluşturmaz. Polar olmayan bağların kopması genellikle zordur.
- Örneğin, O molekülü2 bu tür bir bağlantıya sahip olun. İki oksijen atomu aynı elektronegatifliğe sahip olduğundan, farkları sıfırdır.
Elektronegatiflik farkı 0.5-1.6 arasındaysa, bağ polar bir kovalent bağdır. Bu bağların bir ucunda diğerinden daha fazla elektron var. Bu, molekülün elektronun ucunda biraz daha büyük bir negatif yüke ve diğer ucunda biraz daha büyük bir pozitif yüke sahip olmasına neden olur. Bağdaki yük dengesizliği, molekülün bir dizi özel reaksiyona katılmasına izin verir.
- Moleküler H2O (su) bunun en iyi örneğidir. O atomu, iki H atomundan daha büyük bir elektronegatifliğe sahiptir, bu nedenle elektronları daha sıkı tutar ve tüm molekülün O ucunda bir miktar negatif yük taşımasına ve H ucunda pozitif olarak parçalanmasına neden olur.
Elektronegatiflik farkı 2.0'dan büyükse bağ bir iyonik bağdır. Bu bağda elektronlar tamamen bağın bir ucunda bulunur. Daha büyük bir elektronegatifliğe sahip atomların bir negatif yükü vardır ve daha küçük bir elektronegatifliğe sahip atomların bir pozitif yükü vardır. Bu tür bir bağ, içindeki atomun diğer atomlarla iyi reaksiyona girmesine ve hatta kutupsal atomlarla ayrılmasına izin verir.
- Bir örnek, BaCl molekülüdür (sodyum klorür). Klor atomu o kadar büyük bir negatif yüke sahiptir ki, her iki elektronu da tamamen kendisine doğru çekerek sodyumun pozitif olarak yüklenmesine neden olur.
Elektronegatiflik farkı 1.6-2.0 arasında ise, metalik elemanı kontrol edin. Eğer Sahip olmak bağdaki bir metal eleman bağdır iyonlar. Metalik eleman yoksa bağlanıyor Kutupsal kovalent.
- Metalik elementler, periyodik tablonun solunda ve ortasında bulunan elementlerin çoğunu içerir. Bu sayfada hangi öğelerin metalik olduğunu gösteren bir tablo vardır.
- Yukarıdaki HF örneği bu aralıktadır. H ve F metal olmadıkları için bağlanırlar Kutupsal kovalent.
Yöntem 3/3: Mulliken'e göre elektronegatifliği bulun
Atomun ilk iyonlaştırıcı enerjisini bulun. Mulliken'e göre elektronegatiflik, yukarıda bahsedilen Pauling ölçek yönteminden biraz farklı olan elektronegatifliği ölçmenin bir yöntemidir. Belirli bir atom için Mulliken elektronegatifliğini bulmak için ilk iyonlaştırıcı enerjisini bulun. Bu, atomun bir elektron vermesi için gereken enerjidir.
- Kimyasal referanslarınızda buna bakmanız gerekebilir. Bu sayfa, kullanabileceğiniz bir arama tablosu sağlar (görmek için aşağı kaydırın).
- Örneğin, lityumun (Li) elektronegatifliğini bulmamız gerektiğini varsayalım. Yukarıdaki sayfadaki tabloya baktığımızda, ilk iyonlaşma enerjisinin 520 kJ / mol.
Atomun elektronik yakınlığını bulun. Bu, bir atom negatif bir iyon oluşturmak için bir elektron aldığında elde edilen enerjinin bir ölçüsüdür. Kimyasal referanslarınızda da bu parametreye bakmalısınız. Bu sayfada aramanız gereken öğrenme kaynakları var.
- Lithium'un elektronik yakınlığı 60 kJ mol.
Mulliken'e göre elektronegatiflik denklemlerini çözün. Enerji için kJ / mol kullandığınızda, Mulliken'e göre elektronegatiflik denklemi TRMulliken = (1,97 × 10) (Eben+ Eea) + 0,19. Değerleri denkleme koyun ve EN için çözünMulliken.
- Bu örnekte aşağıdakileri çözeceğiz:
- TRMulliken = (1,97 × 10) (Eben+ Eea) + 0,19
- TRMulliken = (1,97×10)(520 + 60) + 0,19
- TRMulliken = 1,143 + 0,19 = 1,333
- Bu örnekte aşağıdakileri çözeceğiz:
Tavsiye
- Pauling ve Mulliken ölçeklerine ek olarak, diğer bazı elektronegatiflik ölçekleri Allred'dir - Rochow, Sanderson ve Allen. Tüm bu ölçeklerin elektronegatifliği hesaplamak için kendi denklemleri vardır (oldukça karmaşık bir sayı).
- Elektronegatiflik birim yok.