Yazar:
Marcus Baldwin
Yaratılış Tarihi:
20 Haziran 2021
Güncelleme Tarihi:
1 Temmuz 2024

İçerik
- adımlar
- Yöntem 1/5: İyi Çalışma Alışkanlıkları
- Yöntem 2/5: Atomistik yapıyı anlama
- Yöntem 3/5: Kimyasal Reaksiyonların Hesaplanması
- Yöntem 4/5: Hesaplamalar
- Yöntem 5/5: Kimya Dili
- İpuçları
Genel Kimya sınavını geçmek için konunun temellerini bilmek, sayabilmek, daha karmaşık problemler için hesap makinesi kullanmak ve yeni bir şeyler öğrenmeye hazır olmak önemlidir. Kimya maddeleri ve özelliklerini inceler. Çevremizdeki her şey kimya ile ilgilidir, içtiğimiz su ve soluduğumuz hava gibi hafife aldığımız en basit şeyler bile. Sizi çevreleyen her şey hakkında keşiflere hazır olun. Kimyayı tanımak eğlenceli olacak.
adımlar
Yöntem 1/5: İyi Çalışma Alışkanlıkları
 1 Öğretmeniniz veya öğretmeninizle tanışın. Sınavı başarıyla geçmek için eğitmeninizi tanımalı ve size neyin zor olduğunu anlatmalısınız.
1 Öğretmeniniz veya öğretmeninizle tanışın. Sınavı başarıyla geçmek için eğitmeninizi tanımalı ve size neyin zor olduğunu anlatmalısınız. - Öğrencilerin yardıma ihtiyacı olursa birçok öğretmene sınıf dışında ulaşılabilir. Ayrıca, genellikle metodik yayınları vardır.
 2 Pratik yapmak için bir grup oluşturun. Kimyanın sizin için zor olduğundan utanmayın. Bu konu hemen hemen herkes için zordur.
2 Pratik yapmak için bir grup oluşturun. Kimyanın sizin için zor olduğundan utanmayın. Bu konu hemen hemen herkes için zordur. - Bir grup içinde çalışarak, bir konuyu çabucak anlayabilen insanlar, onu başkalarına açıklayacaktır. Böl ve fethet.
 3 Eğitimdeki ilgili paragrafları okuyun. Kimya ders kitapları en heyecan verici okumalar değildir, ancak materyali dikkatlice okumalı ve anlamadığınız metni vurgulamalısınız. Anlamanız zor olan soruların ve kavramların bir listesini yapın.
3 Eğitimdeki ilgili paragrafları okuyun. Kimya ders kitapları en heyecan verici okumalar değildir, ancak materyali dikkatlice okumalı ve anlamadığınız metni vurgulamalısınız. Anlamanız zor olan soruların ve kavramların bir listesini yapın. - Bu kısımlara daha sonra taze bir kafa ile geri dönün. Hala zorlanıyorsanız, konuyu bir grup içinde tartışın veya öğretmeninizden yardım isteyin.
 4 Paragraftan sonra soruları cevaplayınız. Çok fazla materyal olsa bile, düşündüğünüzden daha fazlasını ezberlemiş olabilirsiniz. Bölümün sonundaki soruları cevaplamaya çalışın.
4 Paragraftan sonra soruları cevaplayınız. Çok fazla materyal olsa bile, düşündüğünüzden daha fazlasını ezberlemiş olabilirsiniz. Bölümün sonundaki soruları cevaplamaya çalışın. - Bazen ders kitaplarının sonunda doğru çözümü açıklayan açıklayıcı materyaller bulunur. Bu, akıl yürütmede nerede yanlış yaptığınızı anlamanıza yardımcı olacaktır.
 5 Grafikleri, resimleri ve tabloları inceleyin. Ders kitapları bilgiyi iletmek için görsel araçlar kullanır.
5 Grafikleri, resimleri ve tabloları inceleyin. Ders kitapları bilgiyi iletmek için görsel araçlar kullanır. - Resimlere ve şemalara bakın. Bu, bazı kavramları daha iyi anlamanızı sağlayacaktır.
 6 Dersi bir teybe kaydetmek için eğitmeninizden izin isteyin. Özellikle kimya gibi karmaşık bir konu söz konusu olduğunda, bilgi yazmak ve hala tahtaya bakmak zordur.
6 Dersi bir teybe kaydetmek için eğitmeninizden izin isteyin. Özellikle kimya gibi karmaşık bir konu söz konusu olduğunda, bilgi yazmak ve hala tahtaya bakmak zordur.  7 Önceki sınav sorularına göz atın. Bazen öğrencilere daha iyi hazırlanmaları için önceki yıllarda sınavlarda karşılaştıkları sorular verilir.
7 Önceki sınav sorularına göz atın. Bazen öğrencilere daha iyi hazırlanmaları için önceki yıllarda sınavlarda karşılaştıkları sorular verilir. - Cevapları ezberlemeyin. Kimya, bir soruyu cevaplamak için, sadece ezberlenmiş bir metni tekrarlamakla kalmayıp, ne hakkında olduğunu anlamanın önemli olduğu bir konudur.
 8 Çevrimiçi öğrenme kaynaklarından yararlanın. Eğitmeninizin önerdiği tüm siteleri ziyaret edin.
8 Çevrimiçi öğrenme kaynaklarından yararlanın. Eğitmeninizin önerdiği tüm siteleri ziyaret edin.
Yöntem 2/5: Atomistik yapıyı anlama
 1 En basit bina ile başlayın. Sınav olabilmek için madde olan ve kütlesi olan her şeyin neyden yapıldığını bilmeniz gerekir.
1 En basit bina ile başlayın. Sınav olabilmek için madde olan ve kütlesi olan her şeyin neyden yapıldığını bilmeniz gerekir. - Her şey atomun yapısını anlamakla başlar. Diğer her şey yukarıdan eklenecektir. Atomla ilgili tüm bilgileri çok dikkatli bir şekilde incelemek önemlidir.
 2 Atom kavramını inceleyiniz. Atom, her zaman göremediğimiz maddeler (örneğin gazlar) dahil, kütlesi olan her şeyin en küçük "tuğlasıdır". Ama bir atom bile yapısını oluşturan küçücük parçacıklar içerir..
2 Atom kavramını inceleyiniz. Atom, her zaman göremediğimiz maddeler (örneğin gazlar) dahil, kütlesi olan her şeyin en küçük "tuğlasıdır". Ama bir atom bile yapısını oluşturan küçücük parçacıklar içerir.. - Bir atom üç kısımdan oluşur - nötronlar, protonlar ve elektronlar. Atomun merkezine çekirdek denir. Çekirdek nötron ve protonlardan oluşur. Elektronlar, güneş etrafındaki gezegenler gibi bir atomun dış kabuğu etrafında dönen parçacıklardır.
- Atom çok küçüktür. Bildiğiniz en büyük stadyumu hayal edin. Stadyum bir atom ise, bu atomun çekirdeği bir bezelye büyüklüğündedir.
 3 Bir elementin atomik yapısının ne olduğunu öğrenin. Bir element, doğada daha küçük maddelere bölünemeyen bir maddedir. Elementler atomlardan oluşur.
3 Bir elementin atomik yapısının ne olduğunu öğrenin. Bir element, doğada daha küçük maddelere bölünemeyen bir maddedir. Elementler atomlardan oluşur. - Elementteki atomlar değişmez. Bu, her elementin atomik yapısında belirli bir sayıda nötron ve protona sahip olduğu anlamına gelir.
 4 Çekirdeğin nasıl çalıştığını öğrenin. Çekirdekteki nötronlar nötr bir yüke sahiptir. Protonların pozitif yükü vardır. Bir elementin atom numarası çekirdekteki proton sayısına eşittir..
4 Çekirdeğin nasıl çalıştığını öğrenin. Çekirdekteki nötronlar nötr bir yüke sahiptir. Protonların pozitif yükü vardır. Bir elementin atom numarası çekirdekteki proton sayısına eşittir.. - Çekirdekteki proton sayısını saymaya gerek yoktur. Bu sayı, her element için kimyasal elementlerin periyodik tablosunda belirtilmiştir.
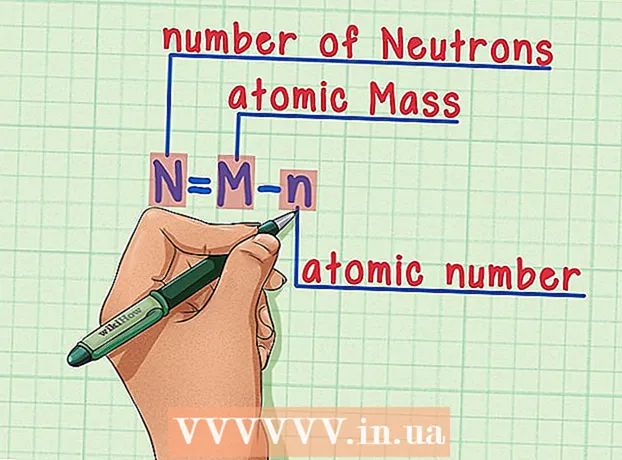
 5 Çekirdekteki nötron sayısını sayın. Periyodik tablodan bir sayı kullanabilirsiniz. Bir elementin atom numarası, çekirdekteki proton sayısı ile aynıdır.
5 Çekirdekteki nötron sayısını sayın. Periyodik tablodan bir sayı kullanabilirsiniz. Bir elementin atom numarası, çekirdekteki proton sayısı ile aynıdır. - Atom kütlesi, her bir elementin karesinin altında adı altında belirtilir.
- Bir atomun çekirdeğinde sadece protonlar ve nötronlar olduğunu unutmayın. Periyodik tabloda proton sayısı ve atom kütlesinin değeri belirtilmiştir.
- Artık her şeyi hesaplamak kolay olacak. Atom kütlesinden proton sayısını çıkarın ve elementin her atomunun çekirdeğindeki nötron sayısını elde edin.
 6 Elektron sayısını sayın. Zıt yüklü parçacıkların birbirini çektiğini unutmayın. Elektronlar pozitif yüklüdür ve atomun etrafında dönerler. Çekirdeğe çekilen negatif yüklü elektronların sayısı, çekirdekteki pozitif yüklü protonların sayısına bağlıdır.
6 Elektron sayısını sayın. Zıt yüklü parçacıkların birbirini çektiğini unutmayın. Elektronlar pozitif yüklüdür ve atomun etrafında dönerler. Çekirdeğe çekilen negatif yüklü elektronların sayısı, çekirdekteki pozitif yüklü protonların sayısına bağlıdır. - Atomun kendisi nötr bir yüke sahip olduğundan, negatif yüklü parçacıkların sayısı, pozitif yüklü parçacıkların sayısına eşit olmalıdır. Bu nedenle elektron sayısı proton sayısına eşittir.
 7 Periyodik element tablosuna bakın. Elementlerin özellikleri sizin için zorsa, periyodik tabloyla ilgili mevcut tüm bilgileri inceleyin.
7 Periyodik element tablosuna bakın. Elementlerin özellikleri sizin için zorsa, periyodik tabloyla ilgili mevcut tüm bilgileri inceleyin. - Periyodik tabloyu anlamak, sınavı başarıyla geçmek için çok önemlidir.
- Periyodik tablo sadece elementlerden oluşur. Her elementin bir alfabetik sembolü vardır, bu sembol her zaman o elementi gösterir. Örneğin, Na her zaman sodyumdur. Elemanın tam adı harf sembolünün altına yerleştirilir.
- Harf sembolünün üzerindeki sayı bir atom numarasıdır. Çekirdekteki proton sayısına eşittir.
- Harf sembolünün altındaki sayı atom kütlesidir. Atom kütlesinin çekirdekteki proton ve nötronların toplamı olduğunu unutmayın.
 8 Elektronik tabloyu okumayı öğrenin. Tabloda sütunların renklerinden, soldan sağa ve yukarıdan aşağıya öğelerin düzenlenmesine kadar birçok bilgi var.
8 Elektronik tabloyu okumayı öğrenin. Tabloda sütunların renklerinden, soldan sağa ve yukarıdan aşağıya öğelerin düzenlenmesine kadar birçok bilgi var.
Yöntem 3/5: Kimyasal Reaksiyonların Hesaplanması
 1 Bir denklem yazın. Kimya dersinde elementlerin bir araya geldiklerinde ne olacağını belirlemeniz öğretilecektir. Kağıt üzerinde buna denklem çözme denir.
1 Bir denklem yazın. Kimya dersinde elementlerin bir araya geldiklerinde ne olacağını belirlemeniz öğretilecektir. Kağıt üzerinde buna denklem çözme denir. - Kimyasal denklem, sol taraftaki maddeler, bir ok ve bir reaksiyon ürününden oluşur. Denklemin bir tarafındaki maddeler diğer taraftaki maddeleri dengelemelidir.
- Örneğin, 1. madde + 2. madde → 1. ürün + 2. ürün.
- Oksitlenmiş haldeki (SnO2) kalay (Sn) alın ve gaz halindeki (H2) hidrojen ile birleştirin. SnO2 + H2 → Sn + H2O.
- Bu denklem dengelenmelidir, çünkü reaktif maddelerin miktarı elde edilen ürünlerin miktarına eşit olmalıdır. Sol tarafta, sağdakinden daha fazla oksijen atomu var.
- Soldaki iki hidrojen birimini ve sağdaki iki su molekülünü değiştirin. Son versiyonda, dengeli denklem şöyle görünür: SnO2 + 2 H2 → Sn + 2 H2O.
 2 Denklemler hakkında yeni bir şekilde düşünün. Denklemleri dengelemeyi zor buluyorsanız, bunun bir reçete olduğunu, ancak her iki tarafın da ayarlanması gerektiğini hayal edin.
2 Denklemler hakkında yeni bir şekilde düşünün. Denklemleri dengelemeyi zor buluyorsanız, bunun bir reçete olduğunu, ancak her iki tarafın da ayarlanması gerektiğini hayal edin. - Görevde sol tarafta size malzemeler veriliyor ancak ne kadar almanız gerektiğini söylemiyor. Denklem ayrıca ne olacağını söylüyor ama ne kadar olduğunu söylemiyor. Öğrenmen gerek.
- Bir önceki denklemi örnek olarak kullanarak, SnO2 + H2 → Sn + H2O, bu formülün neden çalışmayacağını düşünelim. Sn miktarı, H2 miktarı gibi her iki tarafta da eşittir, ancak solda iki kısım oksijen vardır ve sağda sadece bir tane vardır.
- Elde edilen ürünün iki kısım H2O içermesi için denklemin sağ tarafını değiştirmek gerekir. H2O'nun önündeki iki, tüm miktarların iki katına çıkacağı anlamına gelir. Oksijen şimdi dengelenmiştir, ancak 2, sağda soldakinden daha fazla hidrojen olduğu anlamına gelir. Sol tarafa geri dönün ve önüne bir iki koyarak hidrojeni ikiye katlayın.
- Artık her şey dengede. Girdi miktarları çıktı miktarlarına eşittir.
 3 Denkleme daha fazla ayrıntı ekleyin. Kimya derslerinde, elementlerin fiziksel durumunu gösteren sembollerle tanışacaksınız: t - katı, g - gaz, w - sıvı.
3 Denkleme daha fazla ayrıntı ekleyin. Kimya derslerinde, elementlerin fiziksel durumunu gösteren sembollerle tanışacaksınız: t - katı, g - gaz, w - sıvı.  4 Kimyasal reaksiyon sırasında meydana gelen değişiklikleri tanımlamayı öğrenin. Kimyasal reaksiyonlar, reaksiyona giren temel elementler veya bileşiklerle başlar. Bağlantı sonucunda bir reaksiyon ürünü veya birkaç ürün elde edilir.
4 Kimyasal reaksiyon sırasında meydana gelen değişiklikleri tanımlamayı öğrenin. Kimyasal reaksiyonlar, reaksiyona giren temel elementler veya bileşiklerle başlar. Bağlantı sonucunda bir reaksiyon ürünü veya birkaç ürün elde edilir. - Sınavı geçmek için, reaktantları veya bileşik ürünleri veya her ikisini birden içeren denklemleri nasıl çözeceğinizi bilmeniz gerekir.
 5 Farklı reaksiyon türlerini öğrenin. Kimyasal reaksiyonlar, sadece elementler birleştiğinde değil, çeşitli faktörlerin etkisi altında meydana gelebilir.
5 Farklı reaksiyon türlerini öğrenin. Kimyasal reaksiyonlar, sadece elementler birleştiğinde değil, çeşitli faktörlerin etkisi altında meydana gelebilir. - En yaygın reaksiyon türleri sentez, analiz, ikame, çift ayrışma, asitler ve bazlar arasındaki reaksiyon, oksidasyon-indirgenme, yanma, izomerizasyon, hidrolizdir.
- Sınıfta farklı tepkiler üzerinde çalışılabilir - hepsi kursun hedeflerine bağlıdır.Üniversitede, materyalin derinlemesine derecesi okul müfredatından farklı olacaktır.
 6 Mevcut tüm kaynakları kullanın. Temel reaksiyonlar arasındaki farkı anlamanız gerekecek. Bu farkı anlamak için mümkün olan her materyali kullanın. Soru sormaktan korkmayın.
6 Mevcut tüm kaynakları kullanın. Temel reaksiyonlar arasındaki farkı anlamanız gerekecek. Bu farkı anlamak için mümkün olan her materyali kullanın. Soru sormaktan korkmayın. - Kimyasal reaksiyonlar sırasında neyin değiştiğini anlamak o kadar kolay değildir. Bu, kimya dersinizdeki en zorlu görevlerden biri olacaktır.
 7 Tepkileri mantık açısından düşünün. Terminoloji ile kafanızı karıştırmamaya ve işleri daha da karmaşık hale getirmemeye çalışın. Tüm tepkiler, bir şeyi başka bir şeye dönüştürmeyi amaçlar.
7 Tepkileri mantık açısından düşünün. Terminoloji ile kafanızı karıştırmamaya ve işleri daha da karmaşık hale getirmemeye çalışın. Tüm tepkiler, bir şeyi başka bir şeye dönüştürmeyi amaçlar. - Örneğin, iki hidrojen atomunu ve bir oksijen atomunu - suyu birleştirirseniz ne olacağını zaten biliyorsunuzdur. Bu nedenle, bir tencereye su döker ve ateşe verirseniz bir şeyler değişecektir. Kimyasal bir reaksiyon gerçekleştirdiniz. Buzdolabına su koyarsanız, bir reaksiyon meydana gelir. Su olan bir reaktan içeren bir şeyi değiştirdiniz.
- Her şeyi anlayana kadar her tür tepkiyi gözden geçirin. Reaksiyonu tetikleyen enerji kaynağına ve reaksiyondan kaynaklanan büyük değişikliklere odaklanın.
- Bunu anlamakta zorlanıyorsanız, anlaşılmaz nüansların bir listesini yapın ve bunu öğretmeninize, diğer öğrenci arkadaşlarınıza veya kimya konusunda bilgili herkese gösterin.
Yöntem 4/5: Hesaplamalar
 1 Temel hesaplamaların sırasını bilin. Kimyada bazen çok doğru hesaplamalara ihtiyaç duyulur, ancak çoğu zaman temel bir matematik bilgisi yeterlidir. Hesaplamaların hangi sırayla yapıldığını anlamak önemlidir.
1 Temel hesaplamaların sırasını bilin. Kimyada bazen çok doğru hesaplamalara ihtiyaç duyulur, ancak çoğu zaman temel bir matematik bilgisi yeterlidir. Hesaplamaların hangi sırayla yapıldığını anlamak önemlidir. - İlk önce, hesaplamalar parantez içinde yapılır, daha sonra kuvvetler, sonra çarpma veya bölme ve sonunda - toplama veya çıkarma yapılır.
- Örnek 3 + 2 x 6 = ___, doğru cevap 15'tir.
 2 Çok uzun sayıları yuvarlamaktan korkmayın. Kimyada, genellikle bir denklemin cevabı çok sayıda basamak içeren bir sayı olduğu için genellikle yuvarlarlar. Sorun bildiriminde yuvarlama yönergeleri varsa, bunları dikkate alın.
2 Çok uzun sayıları yuvarlamaktan korkmayın. Kimyada, genellikle bir denklemin cevabı çok sayıda basamak içeren bir sayı olduğu için genellikle yuvarlarlar. Sorun bildiriminde yuvarlama yönergeleri varsa, bunları dikkate alın. - Yuvarlamayı bilin. Bir sonraki rakam 4 veya daha az ise aşağı, 5 veya 5'ten büyük ise yukarı yuvarlanmalıdır. Örneğin, burada 6.66666666666666 sayısı var. Görev, cevabı noktadan sonraki ikinci haneye yuvarlamayı söylüyor. Cevap 6.67'dir.
 3 Mutlak değerin ne olduğunu anlayın. Kimyada, bazı sayıların matematiksel değil, mutlak bir anlamı vardır. Mutlak değer, sıfırdan bir sayıya kadar olan tüm değerlerdir.
3 Mutlak değerin ne olduğunu anlayın. Kimyada, bazı sayıların matematiksel değil, mutlak bir anlamı vardır. Mutlak değer, sıfırdan bir sayıya kadar olan tüm değerlerdir. - Başka bir deyişle, artık negatif ve pozitif değerleriniz yok, yalnızca sıfıra olan mesafeniz var. Örneğin, -20'nin mutlak değeri 20'dir.
 4 Tüm yaygın ölçü birimlerini bilin. İşte bazı örnekler.
4 Tüm yaygın ölçü birimlerini bilin. İşte bazı örnekler. - Bir maddenin miktarı mol (mol) cinsinden ölçülür.
- Sıcaklık, Fahrenheit (° F), Kelvin (° K) veya Santigrat (° C) olarak ölçülür.
- Kütle gram (g), kilogram (kg) veya miligram (mg) olarak ölçülür.
- Sıvının hacmi litre (l) veya mililitre (ml) olarak ölçülür.
 5 Değerleri bir ölçüm sisteminden diğerine çevirme alıştırması yapın. Sınavda bu tür çevirilerle uğraşmak zorunda kalacaksınız. Sıcaklığı bir sistemden diğerine, poundu kilograma, onsu litreye çevirmeniz gerekebilir.
5 Değerleri bir ölçüm sisteminden diğerine çevirme alıştırması yapın. Sınavda bu tür çevirilerle uğraşmak zorunda kalacaksınız. Sıcaklığı bir sistemden diğerine, poundu kilograma, onsu litreye çevirmeniz gerekebilir. - Cevabınızı problem cümlesindeki birimlerden farklı birimlerde vermeniz istenebilir. Örneğin, problemin metninde sıcaklık Santigrat derece cinsinden belirtilecek ve cevap Kelvin derece cinsinden gerekli olacaktır.
- Genellikle kimyasal reaksiyonların sıcaklığı Kelvin derece olarak ölçülür. Celsius'u Fahrenheit veya Kelvin'e çevirme alıştırması yapın.
 6 Acele etmeyin. Problemin metnini dikkatlice okuyun ve ölçü birimlerini nasıl dönüştüreceğinizi öğrenin.
6 Acele etmeyin. Problemin metnini dikkatlice okuyun ve ölçü birimlerini nasıl dönüştüreceğinizi öğrenin.  7 Konsantrasyonun nasıl hesaplanacağını bilin. Yüzdeleri, oranları ve oranları hesaplayarak temel matematik bilginizi geliştirin.
7 Konsantrasyonun nasıl hesaplanacağını bilin. Yüzdeleri, oranları ve oranları hesaplayarak temel matematik bilginizi geliştirin.  8 Ambalaj üzerindeki beslenme verileriyle pratik yapın. Kimyayı geçmek için oranları, oranları ve yüzdeleri farklı sıralamalarda hesaplayabilmeniz gerekir.Bu sizin için zorsa, tanıdık ölçü birimleriyle (örneğin, gıda ambalajları üzerinde) eğitime başlayın.
8 Ambalaj üzerindeki beslenme verileriyle pratik yapın. Kimyayı geçmek için oranları, oranları ve yüzdeleri farklı sıralamalarda hesaplayabilmeniz gerekir.Bu sizin için zorsa, tanıdık ölçü birimleriyle (örneğin, gıda ambalajları üzerinde) eğitime başlayın. - Beslenme veri paketini alın. Porsiyon başına kalori hesaplamasını, yüzde olarak önerilen günlük porsiyonu, toplam yağı, yağdan alınan kalori yüzdesini, toplam karbonhidratı ve karbonhidrat türüne göre dağılımını göreceksiniz. Bu değerlere göre farklı oranlar hesaplamayı öğrenin.
- Örneğin, toplam yağdaki tekli doymamış yağ miktarını hesaplayın. Yüzdeye dönüştürün. Porsiyon sayısını ve her porsiyonun kalori içeriğini bilerek bir paketteki kalori sayısını hesaplayın. Paketin yarısında ne kadar sodyum olduğunu hesaplayın.
- Bu, kimyasal değerleri bir sistemden diğerine, örneğin litre başına mol, mol başına gram vb. kolayca çevirmenize yardımcı olacaktır.
 9 Avogadro'nun numarasını kullanmayı öğrenin. Bu sayı, bir moldeki molekül, atom veya parçacıkların sayısını yansıtır. Avogadro sabiti 6.022x1023'tür.
9 Avogadro'nun numarasını kullanmayı öğrenin. Bu sayı, bir moldeki molekül, atom veya parçacıkların sayısını yansıtır. Avogadro sabiti 6.022x1023'tür. - Örneğin, 0.450 mol Fe'de kaç atom vardır? Cevap: 0,450 x 6.022x1023.
 10 Havuçları düşün. Avogadro sayısını nasıl kullanacağınızı bulmakta zorlanıyorsanız, atom, molekül veya parçacık yerine havuç saymayı deneyin. Bir düzinede kaç havuç var? Bir düzinenin 12 olduğunu biliyoruz, yani bir düzinede 12 havuç var.
10 Havuçları düşün. Avogadro sayısını nasıl kullanacağınızı bulmakta zorlanıyorsanız, atom, molekül veya parçacık yerine havuç saymayı deneyin. Bir düzinede kaç havuç var? Bir düzinenin 12 olduğunu biliyoruz, yani bir düzinede 12 havuç var. - Şimdi bir köstebeğin içinde kaç tane havuç var sorusuna cevap verelim. 12 ile çarpmak yerine Avogadro sayısı ile çarpıyoruz. Bir köstebeğin içinde 6.022 x 1023 havuç vardır.
- Avogadro sayısı, herhangi bir atom, molekül, parçacık veya havuç değerini mollere dönüştürmek için kullanılır.
- Bir maddenin mol sayısını biliyorsanız, o zaman molekül, atom veya parçacık sayısının değeri, bu sayının Avogadro sayısı ile çarpımına eşit olacaktır.
- Parçacıkların mollere nasıl dönüştüğünü anlamak sınavda önemli bir faktördür. Mol dönüşümleri, oran ve orantı hesaplamalarının bir parçasıdır. Başka bir şeyin parçası olarak mol cinsinden bir şeyin miktarı anlamına gelir.
 11 Molariteyi anlayın. Bir sıvıdaki bir maddenin mol sayısını düşünün. Bu örneği anlamak çok önemlidir çünkü molariteden, yani bir maddenin litre başına mol olarak ifade edilen oranından bahsediyoruz.
11 Molariteyi anlayın. Bir sıvıdaki bir maddenin mol sayısını düşünün. Bu örneği anlamak çok önemlidir çünkü molariteden, yani bir maddenin litre başına mol olarak ifade edilen oranından bahsediyoruz. - Molarite veya molar konsantrasyon, bir sıvıdaki bir maddenin miktarını, yani bir çözeltideki çözünen miktarını ifade eden bir terimdir. Molariteyi elde etmek için, çözünenin mollerini çözeltinin litresine bölmeniz gerekir. Molarite, litre başına mol olarak ifade edilir.
- Yoğunluğu hesaplayın. Yoğunluk genellikle kimyada kullanılır. Yoğunluk, birim hacim başına bir kimyasalın kütlesidir. Tipik olarak yoğunluk, mililitre başına gram veya santimetreküp başına gram olarak ifade edilir - aynı şeydir.
 12 Denklemleri ampirik bir formüle indirgeyin. Bu, yalnızca tüm değerleri en basit biçimine getirirseniz cevabın doğru olacağı anlamına gelir.
12 Denklemleri ampirik bir formüle indirgeyin. Bu, yalnızca tüm değerleri en basit biçimine getirirseniz cevabın doğru olacağı anlamına gelir. - Bu, molekülü oluşturan kimyasal elementlerin tam oranlarını gösterdikleri için moleküler formüller için geçerli değildir.
 13 Moleküler formüle nelerin dahil olduğunu bilin. Molekülün tam olarak neyden yapıldığını söylediği için moleküler formülün en basit veya ampirik forma getirilmesi gerekmez.
13 Moleküler formüle nelerin dahil olduğunu bilin. Molekülün tam olarak neyden yapıldığını söylediği için moleküler formülün en basit veya ampirik forma getirilmesi gerekmez. - Moleküler formül, elementlerin kısaltmaları ve moleküldeki her elementin atom sayısı kullanılarak yazılır.
- Örneğin, suyun moleküler formülü H2O'dur. Bu, her su molekülünün iki hidrojen atomu ve bir oksijen atomu içerdiği anlamına gelir. Asetaminofenin moleküler formülü C8H9NO2'dir. Her kimyasal bileşiğin moleküler bir formülü vardır.
 14 Kimyadaki matematiğin stokiyometri olarak adlandırıldığını unutmayın. Bu terimle karşılaşacaksınız. Bu, kimyanın matematiksel formüllerde nasıl ifade edildiğinin bir açıklamasıdır. Kimyasal matematikte veya stokiyometride, elementlerin ve kimyasal bileşiklerin miktarları genellikle mol, yüzdeler mol, litre başına mol veya kilogram başına mol olarak ifade edilir.
14 Kimyadaki matematiğin stokiyometri olarak adlandırıldığını unutmayın. Bu terimle karşılaşacaksınız. Bu, kimyanın matematiksel formüllerde nasıl ifade edildiğinin bir açıklamasıdır. Kimyasal matematikte veya stokiyometride, elementlerin ve kimyasal bileşiklerin miktarları genellikle mol, yüzdeler mol, litre başına mol veya kilogram başına mol olarak ifade edilir. - Gramları mollere dönüştürmeniz gerekecek.Bir elementin gram cinsinden bir biriminin atom kütlesi, bu maddenin bir molüne eşittir. Örneğin, kalsiyumun atom kütlesi 40 atomik kütle birimidir. Yani 40 gram kalsiyum bir mol kalsiyuma eşittir.
 15 Ek görevler isteyin. Denklemler ve dönüşümler sizin için zorsa, öğretmeninizle konuşun. Tüm fenomenlerin özünü anlayana kadar kendi başınıza çalışabilmeniz için daha fazla görev isteyin.
15 Ek görevler isteyin. Denklemler ve dönüşümler sizin için zorsa, öğretmeninizle konuşun. Tüm fenomenlerin özünü anlayana kadar kendi başınıza çalışabilmeniz için daha fazla görev isteyin.
Yöntem 5/5: Kimya Dili
 1 Lewis çizelgelerini anlamayı öğrenin. Lewis çizelgelerine bazen dağılım çizelgeleri denir. Bunlar, noktaların bir atomun dış kabuğundaki serbest ve bağlı elektronları temsil ettiği basit diyagramlardır.
1 Lewis çizelgelerini anlamayı öğrenin. Lewis çizelgelerine bazen dağılım çizelgeleri denir. Bunlar, noktaların bir atomun dış kabuğundaki serbest ve bağlı elektronları temsil ettiği basit diyagramlardır. - Böyle bir sistem, örneğin kovalent gibi bir atom veya moleküldeki elementler arasındaki bağları yansıtacak basit diyagramlar çizmenize izin verir.
 2 Oktet kuralının ne olduğunu öğrenin. Lewis diyagramları oluşturulurken, bir atomun dış kabuğunda sekiz elektrona erişimi olduğunda kararlı hale geldiğini belirten oktet kuralı kullanılır. Hidrojen bir istisnadır - dış kabukta iki elektron olduğunda kararlı olarak kabul edilir.
2 Oktet kuralının ne olduğunu öğrenin. Lewis diyagramları oluşturulurken, bir atomun dış kabuğunda sekiz elektrona erişimi olduğunda kararlı hale geldiğini belirten oktet kuralı kullanılır. Hidrojen bir istisnadır - dış kabukta iki elektron olduğunda kararlı olarak kabul edilir.  3 Bir Lewis diyagramı çizin. Elemanın harf sembolü noktalarla çevrilidir ve bir Lewis diyagramıdır. Diyagramın bir film karesi olduğunu hayal edin. Elektronlar, elementlerin dış kabuğu etrafında dönmezler - belirli bir süre içinde yansıtılırlar.
3 Bir Lewis diyagramı çizin. Elemanın harf sembolü noktalarla çevrilidir ve bir Lewis diyagramıdır. Diyagramın bir film karesi olduğunu hayal edin. Elektronlar, elementlerin dış kabuğu etrafında dönmezler - belirli bir süre içinde yansıtılırlar. - Diyagram, başka bir elemente bağlı oldukları sabit elektron kütlesini ve bağ hakkındaki bilgileri (örneğin, bağların iki katına çıkıp çıkmadığını ve birkaç elektron arasında paylaşılıp paylaşılmadığını) gösterir.
- Oktet kuralını düşünün ve bir element sembolü hayal edin - örneğin, C (karbon). Sembolün doğusuna, batısına, kuzeyine ve güneyine ikişer nokta çizin. Şimdi noktaların her birinin yanına bir H (hidrojen atomu) sembolü çizin. Diyagram, her bir karbon atomunun dört hidrojen atomu ile çevrili olduğunu göstermektedir. Elektronları kovalent olarak bağlıdır, yani karbon ve hidrojen atomları için elektronlardan biri ikinci elementin bir elektronuna bağlıdır.
- Böyle bir bileşiğin moleküler formülü CH4'tür. Metan gazıdır.
 4 Elektronların elementleri nasıl bağladığını anlayın. Lewis diyagramları kimyasal bağları basit bir biçimde temsil eder.
4 Elektronların elementleri nasıl bağladığını anlayın. Lewis diyagramları kimyasal bağları basit bir biçimde temsil eder. - Elemanların nasıl bağlantılı olduğunu ve Lewis diyagramlarının neyi temsil ettiğini anlamadıysanız, bu konuyu öğretmeniniz ve sınıf arkadaşlarınızla tartışın.
 5 Bağlantıların ne dendiğini öğrenin. Kimyanın kendi terminoloji kuralları vardır. Reaksiyon türleri, dış kabuktaki elektronların kaybı veya kazanımı ve elementlerin kararlılığı veya kararsızlığı kimya terminolojisinin bir parçasıdır.
5 Bağlantıların ne dendiğini öğrenin. Kimyanın kendi terminoloji kuralları vardır. Reaksiyon türleri, dış kabuktaki elektronların kaybı veya kazanımı ve elementlerin kararlılığı veya kararsızlığı kimya terminolojisinin bir parçasıdır.  6 Bunu ciddiye alın. Birçok kimya dersinin bunun için ayrı bölümleri vardır. Çoğu zaman, terminolojiyi bilmemek sınavda başarısız olmak anlamına gelir.
6 Bunu ciddiye alın. Birçok kimya dersinin bunun için ayrı bölümleri vardır. Çoğu zaman, terminolojiyi bilmemek sınavda başarısız olmak anlamına gelir. - Mümkünse, terminolojiyi dersten önce çalışın. Özel yayınları normal bir kitapçıdan veya internetten satın alabilirsiniz.
 7 Çizginin üstündeki ve altındaki sayıların ne anlama geldiğini bilin. Bu kimya öğrenmenin çok önemli bir parçasıdır.
7 Çizginin üstündeki ve altındaki sayıların ne anlama geldiğini bilin. Bu kimya öğrenmenin çok önemli bir parçasıdır. - Çizginin üzerindeki sayılar periyodik element tablosunda görülebilir. Bir elementin veya kimyasal bileşiğin toplam yükünü temsil ederler. Periyodik tabloyu ve aynı indeks numaralarına sahip dikey sıralardaki elemanları inceleyin.
- Satırın altındaki sayılar, bileşiğe giren her bir elementin miktarını tanımlamak için kullanılır. Daha önce belirtildiği gibi, H2O formülündeki 2, su molekülünde iki hidrojen atomu olduğunu gösterir.
 8 Atomların birbirleriyle nasıl reaksiyona girdiğini anlayın. Terminolojide, belirli reaksiyon türlerinin ürünlerini adlandırırken uyulması gereken özel kurallar vardır.
8 Atomların birbirleriyle nasıl reaksiyona girdiğini anlayın. Terminolojide, belirli reaksiyon türlerinin ürünlerini adlandırırken uyulması gereken özel kurallar vardır. - Reaksiyonlardan biri oksidasyon-redüksiyondur. Reaksiyon sırasında elektron alımı veya kaybı meydana gelir.
- Elektronlar oksidasyon sırasında kaybolur ve indirgeme sırasında alınır.
 9 Satırın altındaki sayıların, bileşiğin kararlı yük formülünü gösterebileceğini unutmayın. Bilim adamları, bir bileşiğin son moleküler formülünü tanımlamak için bunun gibi sayıları kullanır; bu, aynı zamanda, nötr yüklü kararlı bir bileşiği de belirtir.
9 Satırın altındaki sayıların, bileşiğin kararlı yük formülünü gösterebileceğini unutmayın. Bilim adamları, bir bileşiğin son moleküler formülünü tanımlamak için bunun gibi sayıları kullanır; bu, aynı zamanda, nötr yüklü kararlı bir bileşiği de belirtir. - Nötr bir yük elde etmek için, katyon adı verilen pozitif yüklü bir iyon, negatif bir iyondan, bir anyondan eşit bir yük ile dengelenmelidir. Bu ücretler satırın altında yazılır.
- Örneğin, magnezyum iyonunda katyon yükü +2 ve azot iyonunda anyon yükü -3 vardır. +2 ve -3 satırın altında gösterilir. Nötr bir yük elde etmek için her 2 birim nitrojen için 3 atom magnezyum kullanmanız gerekir.
- Formülde bu şu şekilde yazılmıştır: Mg3N2
 10 Anyonları ve katyonları periyodik element tablosundaki konumlarına göre tanımayı öğrenin. Tabloda ilk sütunda yer alan elementler alkali metallerdir ve +1 katyon yüküne sahiptirler. Örneğin, Na + ve Li +.
10 Anyonları ve katyonları periyodik element tablosundaki konumlarına göre tanımayı öğrenin. Tabloda ilk sütunda yer alan elementler alkali metallerdir ve +1 katyon yüküne sahiptirler. Örneğin, Na + ve Li +. - İkinci sütundaki toprak alkali metaller Mg2+ ve Ba2+ gibi 2+ katyon yüküne sahiptir.
- Yedinci sütundaki elementlere halojen denir ve Cl- ve I- gibi -1 anyon yüküne sahiptir.
 11 Ortak anyonları ve katyonları tanımayı öğrenin. Sınavı geçmek için, öğe gruplarıyla ilgili tüm terminolojiyi öğrenin. Satırın altındaki bu sayılar değişmez.
11 Ortak anyonları ve katyonları tanımayı öğrenin. Sınavı geçmek için, öğe gruplarıyla ilgili tüm terminolojiyi öğrenin. Satırın altındaki bu sayılar değişmez. - Başka bir deyişle, magnezyum her zaman +2 katyon yüküyle Mg'dir.
 12 Bilgilerle kafanızı karıştırmamaya çalışın. Farklı kimyasal reaksiyon türleri, elektron değişimi, bir elementin veya bileşeninin yükündeki değişiklik hakkında bilgiler sizden geçecektir ve tüm bunların özümsenmesi zor olacaktır.
12 Bilgilerle kafanızı karıştırmamaya çalışın. Farklı kimyasal reaksiyon türleri, elektron değişimi, bir elementin veya bileşeninin yükündeki değişiklik hakkında bilgiler sizden geçecektir ve tüm bunların özümsenmesi zor olacaktır. - Zor konuları parçalara ayırın. Örneğin, oksidasyon reaksiyonunu veya elementleri pozitif ve negatif yükler ile birleştirme ilkesini anlamıyorsanız, bildiğiniz tüm bilgileri konuşmaya başlayın ve zaten çok şeyi anlamayı ve hatırlamayı başardığınızı anlayacaksınız.
 13 Öğretmeninizle düzenli olarak sohbet edin. Zor konuların bir listesini yapın ve öğretmeninizden size yardım etmesini isteyin. Bu size grup bir sonraki konuya geçmeden önce materyali içselleştirme şansı verecek ve bu da kafanızı daha da karıştıracaktır.
13 Öğretmeninizle düzenli olarak sohbet edin. Zor konuların bir listesini yapın ve öğretmeninizden size yardım etmesini isteyin. Bu size grup bir sonraki konuya geçmeden önce materyali içselleştirme şansı verecek ve bu da kafanızı daha da karıştıracaktır.  14 Kimyanın yeni bir dil öğrenmek gibi olduğunu hayal edin. Yazma yüklerinin, bir moleküldeki atom sayısının ve moleküller arasındaki bağın kimya dilinin bir parçası olduğunu anlamak önemlidir. Bütün bunlar, doğada olanları kağıt üzerinde yansıtır.
14 Kimyanın yeni bir dil öğrenmek gibi olduğunu hayal edin. Yazma yüklerinin, bir moleküldeki atom sayısının ve moleküller arasındaki bağın kimya dilinin bir parçası olduğunu anlamak önemlidir. Bütün bunlar, doğada olanları kağıt üzerinde yansıtır. - Tüm süreçler canlı olarak gözlemlenebilseydi tüm bunları anlamak çok daha kolay olurdu. Yalnızca süreçlerin ilkelerini değil, aynı zamanda bu bilgileri kaydetmek için kullanılan dili de anlamanız önemlidir.
- Kimya çalışmakta zorlanıyorsanız, yalnız olduğunuzu unutmayın ve pes etmeyin. Eğitmeninizle, grubunuzla veya konuyla ilgili bilgisi olan herhangi biriyle konuşun. Bütün bunlar öğrenilebilir, ancak birisi materyali size açıklarsa, her şeyi anlamanız için daha doğru olur.
İpuçları
- Dinlenmeyi unutmayın. Çalışmalarınıza ara vermek, okula taze bir zihinle dönmenizi sağlayacaktır.
- Sınav arifesinde biraz uyuyun. Uyuyan bir kişinin hafızası ve konsantrasyonu daha iyidir.
- Zaten bildiklerinizi tekrar okuyun. Kimya, bir fenomenin incelenmesi ve bilginin genişletilmesi üzerine kurulmuş bir bilimdir. Sınavdaki sorunun sizi şaşırtmaması için öğrendiğiniz her şeyi hafızanızda tutmanız önemlidir.
- Derse hazır olun. Tüm materyalleri okuyun ve ödevinizi yapın. Bir şeyi kaçırırsanız daha da geride kalacaksınız.
- Zaman ayırın. Bu konu sana iyi gelmiyorsa kimyaya daha çok dikkat et ama bütün zamanını ona ayırma çünkü başka konular da var.